
| A、为保护海轮的船壳,常在船壳上镶入锌块 |
| B、纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 |
| C、已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| D、Na2O2与水反应中,氧化剂还原剂都是Na2O2,且1mol Na2O2参加反应有1mol电子转移 |


科目:高中化学 来源: 题型:
| A、2:3 | B、3:2 |
| C、1:3 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
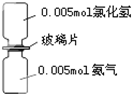 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英坩埚耐高温,可用来加热熔化NaOH固体 |
| B、浓硫酸有脱水性,可用作干燥剂 |
| C、二氧化硫有漂白性,可大量用于加工食品使食品漂白 |
| D、医用酒精能使蛋白质变性,可用来消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
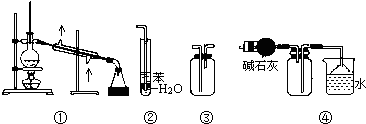
| A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C、装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用人工光合成反应,探究将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 |
| B、开发安全、高效、低毒及低残留的新型农药 |
| C、加大稀土资源的开采和出口,制造更多高新产品,保证经济快速发展 |
| D、制备物质时探究化学反应中高选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
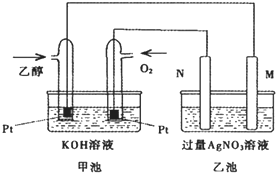 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- | ||
| B、0.1mol/LFeCl3溶液:K+、NH4+、I-、SCN- | ||
| C、0.1mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com