
| A. | 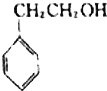 | B. | 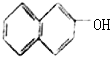 | C. | 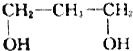 | D. | 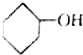 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

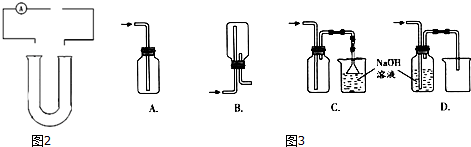
 .D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.
.D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱液中通入过量的二氧化碳:2OH-+CO2═CO32-+H2O | |
| B. | 向纯碱溶液通入足量的二氧化碳:CO32-+CO2+H2O═2HCO3- | |
| C. | 向硅酸钠水液中通人少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通人少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25%和7.5akJ | B. | 25%和3bkJ | C. | 75%和(a-b) kJ | D. | 75%和(10a-b) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶盐不存在沉淀溶解平衡 | |
| B. | 可通过调节溶液pH或加入沉淀剂使某些金属离子沉淀 | |
| C. | 某离子在溶液中沉淀完全,则该离子在溶液中已不存在 | |
| D. | 一般,溶解度小的易转化成溶解度更小的,而溶解度更小的不能转化成溶解度小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
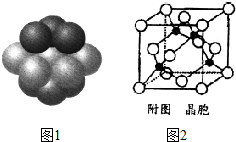
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4 CBr4 CsCl SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com