
| A. | 能发生银镜反应且与单质钠产生气体的同分异构体有3种 | |
| B. | 能水解的X有4种同分异构体,能与NaHCO3反应的X有3种同分异构体 | |
| C. | X的某种同分异构体水解后的一种产物可以通过两步连续氧化得到另一水解产物 | |
| D. | X分子中不可能含有两个羟基 |
分析 A、能发生银镜反应且与单质钠产生气体,说明C4H8O2属于羟基醛,可以根据官能团的位置异构得到其同分异构体;
B、能水解,说明C4H8O2属于酯类,为饱和一元酯,根据酸和醇的种类来确定同分异构体;能与NaHCO3反应,说明C4H8O2属于羧酸,可以根据羧基位置异构确定同分异构体;
C、C4H8O2若为乙酸乙酯,水解后生成乙酸、乙醇,乙醇通过两步连续氧化得到乙酸;
D、C4H8O2的不饱和度为1,分子中可以含有1个双键,2个羟基或可以含有1个碳环,2个羟基.
解答 解:A、C4H8O2属于羟基醛时,可以是2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3羟基丙醛,共5种同分异构体,故A错误;
B、C4H8O2属于酯类的同分异构体,为饱和一元酯,若为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇有2种,形成的酯有2种,若为乙酸与乙醇形成的酯,乙酸只有1种结构,乙醇只有1种结构,形成的乙酸乙酯有1种,若为丙酸与甲醇形成的酯,丙酸只有1种结构,甲醇只有1种结构,形成的丙酸甲酯只有1种,所以C4H8O2属于酯类的同分异构体共有4种;C4H8O2属于羧酸时,有2种同分异构体:丁酸、2-甲基丙酸,故B错误;
C、C4H8O2若为乙酸乙酯,水解后生成乙酸、乙醇,乙醇通过两步连续氧化得到乙酸,即水解后的一种产物可以通过两步连续氧化得到另一水解产物,故C正确;
D、C4H8O2的不饱和度为1,分子中可以含有1个双键,2个羟基或可以含有1个碳环,2个羟基,即分子中可能含有两个羟基,故D错误.
故选C.
点评 本题考查同分异构体的种类,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度不大,有利于培养学生的逻辑推理能力.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL2mol•L-1 CaCl2溶液 | B. | 150mL2mol•L-1NaCl溶液 | ||
| C. | 150mL2mol•L-1KClO3溶液 | D. | 75mL1mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 饱和溶液 | 加入的少量物质 | |
| A | NaHCO3 | 石灰水 |
| B | 盐酸 | 氢氧化钠溶液 |
| C | Na2CO3 | CO2 |
| D | Ca(OH)2 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
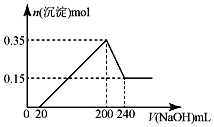 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1 mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}$×10-18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com