
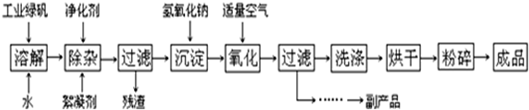
分析 (1)Fe3O4中含有+2价铁,具有还原性,可与稀硝酸发生氧化还原反应生成Fe3+和NO;可用KSCN溶液检验Fe3+;
(2)加入氢氧化钠生成Fe(OH)2,Fe(OH)2不稳定,易被空气中的氧气氧化生成Fe(OH)3;
(3)反应流程所用原料为绿矾和氢氧化钠,除生成Fe3O4外,副产品为Na2SO4•10H2O(或Na2SO4),从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
(4)根据反应的化学方程式进行分析.
解答 解:(1)Fe3O4中含有+2价铁,具有还原性,可与稀硝酸发生氧化还原反应生成Fe3+和NO,反应的离子发生为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,可用KSCN溶液检验Fe3+,可取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;KSCN溶液;
(2)加入氢氧化钠生成Fe(OH)2,Fe(OH)2不稳定,易被空气中的氧气氧化生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)反应流程所用原料为绿矾和氢氧化钠,除生成Fe3O4外,副产品为Na2SO4•10H2O(或Na2SO4),由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤,即bcad,
故答案为:Na2SO4•10H2O(或Na2SO4);bcad;
(5)鼓入的空气应恰好与FeSO4完全反应,12.16 kg工业绿矾中含FeSO4的物质的量:$\frac{12160g×52.5%}{152g/mol}$=42mol,
设鼓入空气的速率应为Vm3/h,
根据:6 FeSO4∽O2∽2 Fe3O4
6mol 22.4L
42mol Vm3×103L/m3×1/5
解得:V=0.784
故答案为:0.784.
点评 本题考查较为综合,对学生的心理素质有非常高的要求,考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、离子检验等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=3的溶液中:K+、Ba2+、Cl-、Br- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 含有0.1mol•L-1NO3-的溶液中:Na+、H+、SO42-、Fe2+ | |
| D. | 含有大量AlO2-的溶液中:NH4+、NO3-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单气态氢化物在一定条件下可被Q单质氧化 | |
| B. | Y的简单离子半径小于Z的简单离子半径 | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-已醇的沸点比已烷的沸点高89℃ | 1-已醇和已烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
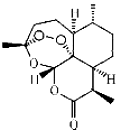 屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )| A. | 青蒿素是无机物 | |
| B. | 青蒿索的摩尔质量为282 | |
| C. | 屠呦呦发现用乙醚提取青蒿素效果很好,表明青蒿素难溶于水,易溶于乙醚,在水中溶解度不大 | |
| D. | 屠呦呦获得的是诺贝尔生理学或医学奖,说明无需学好化学,也能在医学上取得非凡的成绩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
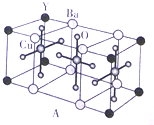 NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题:
NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题: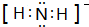 其中心原子的杂化类型是sp3
其中心原子的杂化类型是sp3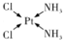 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com