
【题目】利用海洋资源获得的部分物质如下图所示,有关说法正确的是
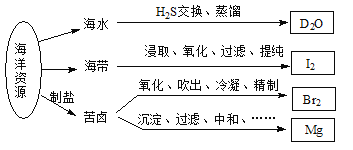
A. 在化学反应中,![]() H2O可转变为D2O
H2O可转变为D2O
B. “加碘食盐”生产中碘添加剂为单质I2
C. 实验室用带玻璃塞的棕色瓶贮存液Br2
D. 电解饱和MgCl2溶液时在阴极得到Mg
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有机物(![]() )的名称为2-甲基-1-丙醇
)的名称为2-甲基-1-丙醇
B. 芥子醇( )能发生氧化、取代、水解、加聚反应
)能发生氧化、取代、水解、加聚反应
C. 1mol绿原酸( )与足量溴水反应,最多消耗4molBr2
)与足量溴水反应,最多消耗4molBr2
D. 有机物(俗称“一滴香”)( )的一种含苯环的同分异构体能发生银镜反应
)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阳极X和阴极Y电解足量Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
选项 | 阳极X | 阴极Y | Z | W |
A | C | Fe | KCl | KOH |
B | Pt | Cu | CuSO4 | Cu(OH)2溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
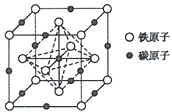
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国科学家希尔发现,离体的叶绿体悬浮液中加入适当的电子受体(如草酸铁),在光照时可使水分解而释放氧气,从而证明了氧的释放与CO2还原是不同的过程,将对光合作用的研究上升到细胞层面。该反应方程式为4Fe3++2H2O![]() 4Fe2++4H++O2↑,下列有关希尔反应说法错误的是( )
4Fe2++4H++O2↑,下列有关希尔反应说法错误的是( )
A. 水在光反应中起供氢体和电子供体双重作用
B. 反应后溶液pH减小
C. 生成标准状况下11.2 L O2时,Fe3+得电子数为2NA
D. 叶绿体本身被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、![]() 、酒精、NaCl溶液,振荡后静置,现象正确的是
、酒精、NaCl溶液,振荡后静置,现象正确的是![]()
![]()
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈黄褐色D.Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
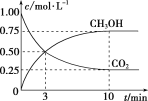
①0~10 min内,氢气的平均反应速率为____________,第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1;2H2(g)+O2(g)===2H2O(g) ΔH=-b kJ·mol-1;H2O(g)===H2O(l) ΔH=-c kJ·mol-1;CH3OH(g)===CH3OH(l) ΔH=-d kJ·mol-1。则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)如图,25 ℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解600 mL一定浓度的NaCl溶液,电池的负极反应式为_________________________________。
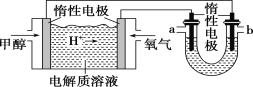
在电解一段时间后,NaCl溶液的 pH 变为12(假设电解前后NaCl溶液的体积不变,阳极产物只有Cl2),则理论上消耗甲醇的物质的量为________mol。
(3)向(2)U形管内电解后的溶液(假设NaCl溶液完全被电解)中通入标准状况下89.6 mL 的CO2气体,则所得溶液呈________(填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
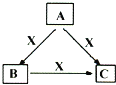
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的相对分子质量比乙的相对分子质量小
D.甲的物质的量比乙的物质的量少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com