
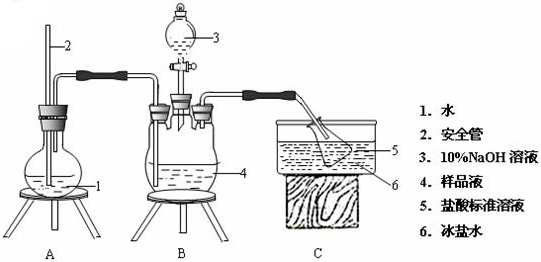
分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)弱电解质存在电离平衡,CH3COOH?CH3COO-+H+,常数Ka=$\frac{[C{H}_{3}CO{O}^{-}][{H}^{+}]}{[C{H}_{3}COOH]}$,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,代入计算得到平衡常数,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小;
(3)①将浓度均为0.1mol•L-1的盐酸和氨水等体积混合恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性;
②氯化铵溶液水解显酸性;
③依据溶液中电荷守恒计算.
解答 解:(1)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为烧杯、玻璃棒、托盘天平、100mL容量瓶和胶头滴管,
故答案为:胶头滴管、100mL容量瓶;
(2)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,弱电解质存在电离平衡,CH3COOH?CH3COO-+H+,常数Ka=$\frac{[C{H}_{3}CO{O}^{-}][{H}^{+}]}{[C{H}_{3}COOH]}$,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为$\frac{1{0}^{-3}mol/L×1{0}^{-3}mol/L}{0.1mol/L}$=10-5mol/L,
向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值减小,
故答案为:10-5 mol•L-1;减小;
(3)①将浓度均为0.1mol•L-1的盐酸和氨水等体积混合恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性,反应的离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:酸性;NH4++H2O?NH3•H2O+H+;
②将浓度均为0.1mol•L-1的盐酸和氨水等体积混合恰好反应生成氯化铵溶液,铵根离子水解溶液显酸性,溶液中离子浓度大小为:[Cl-]>[NH4+]>[H+]>[OH-],
故答案为:[Cl-]>[NH4+]>[H+]>[OH-];
③25℃时,使用pH计测得此混合溶液的pH为a,溶液中存在电荷守恒[Cl-]+[OH-]=[NH4+]+[H+],[NH4+]=[Cl-]+[OH-]-[H+]=0.05+$\frac{1{0}^{-14}}{1{0}^{-a}}$-10-a=0.05+10a-14-10-a ,
故答案为:0.05+10a-14-10-a.
点评 本题考查了溶液配制,弱电解质电离平衡影响因素和电离平衡常数的计算,电解质溶液中离子浓度大小比较、盐类水解的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 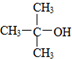 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 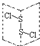 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:
已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有电子得失 | B. | 凡是能电离出H+的化合物均属于酸 | ||
| C. | 离子反应不一定是氧化还原反应 | D. | 置换反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是复分解反应 | |
| B. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | 生成2 mol ClO2时转移的电子数为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 篮烷的分子式为C12H20 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com