
| A | 实验操作 | 预测的实验现象 |
| B | 向Na2CO3溶液中滴加盐酸 | 立即有气体逸出 |
| C | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 试纸褪色 |
| D | 铅箔在酒精灯火焰上加热 | 铝熔化但不会滴下 |
| 向淀粉的水解液中加入新制Cu(OH)2悬浊液并加热 | 一定有砖红色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.滴加盐酸,先反应生成碳酸氢钠;
B.浓硫酸滴加到盛有铜片上,二者反应需要加热;
C.氧化铝的熔点高,包裹在Al的外面;
D.淀粉水解后生成葡萄糖,检验葡萄糖应在碱性条件下.
解答 解:A.滴加盐酸,先反应生成碳酸氢钠,不能立即生成气体,故A错误;
B.浓硫酸滴加到盛有铜片上,二者反应需要加热,不加热不生成二氧化硫,故B错误;
C.氧化铝的熔点高,包裹在Al的外面,则加热时铝熔化但不会滴下,故C正确;
D.淀粉水解后生成葡萄糖,检验葡萄糖应在碱性条件下,没有加碱至碱性,不能检验葡萄糖,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、有机物的检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
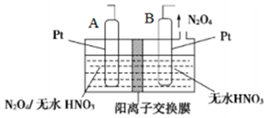 氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀豆浆、食盐水均可产生丁达尔效应 | |
| B. | 利用生物质能就是间接利用太阳能 | |
| C. | 钢铁在潮湿的空气中主要发生化学腐蚀 | |
| D. | 纯铝质轻,耐腐蚀性强,可直接用作航天材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL12Lmol•L-1浓盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 1mol•L-1的NaClO溶液中含有ClO-的数目为小于NA | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| D. | O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W和X形成的化合物可能含有非极性共价键 | |
| B. | X和Z形成的化合物常温下可能为固态 | |
| C. | W、X、Y、Z四种元素组成的化合物的水溶液可能呈酸性 | |
| D. | W、X、Y、Z四种元素两两之间均能形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
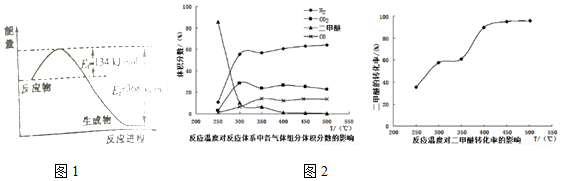
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | Fe2O3$\stackrel{稀盐酸}{→}$FeCl3$\stackrel{蒸发,灼烧}{→}$无水FeCl3 | |
| C. | 纤维素$→_{△}^{浓硫酸}$葡萄糖$→_{酶}^{O_{2}}$CO2+H2O | |
| D. | 饱和NaCl溶液$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.4 mol | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com