
【题目】下列实验中,所选装置或实验设计合理的是

A. 图⑤所示装置中盛有饱和NaOH溶液用以除去CO2中含有的少量HCl气体
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图①和②所示装置进行粗盐提纯
D. 用图④所示装置可把由5种沸点相差较大的液体组成的混合物中的成分一一分离出来
科目:高中化学 来源: 题型:
【题目】碳酸镧咀嚼片是一种不含钙和铝的磷酸盐结合剂,用于慢性肾衰患者高磷血症的治疗。碳酸镧可由 LaCl3 为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[La(OH)CO3]。
(1)化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。
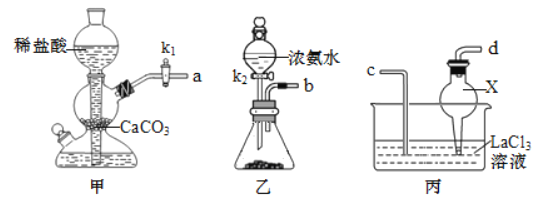
①仪器 X 的名称为________;检验装置甲气密性良好的方法是___________。
②实验中 K1、 K2 打开的先后顺序为________;为保证碳酸镧的纯度,实验过程中需要注意的问题有____________。
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,过程中会发生两个平行反应,其离子方程式为_______和____________。
②选择碳酸氢钠溶液制备碳酸镧的优点是___________(任写一条)。
③T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1, HCO3-的电离平衡常数为 6.0×10-11。请计算反应 2LaCl3+3NaHCO3![]() La2(CO3)3↓+3NaCl+3HCl 的平衡常数 K=_________。
La2(CO3)3↓+3NaCl+3HCl 的平衡常数 K=_________。
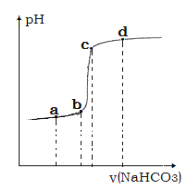
④利用手持技术测定溶液的 pH 从而监控反应过程,得到如图曲线。请说明 bc 段变化的原因__________。
(3)碳酸镧(式量为 458)质量分数的测定:准确称取15.0g产品试样,溶于10.0mL 稀盐酸中,加入 10mLNH3-NH4Cl 缓冲溶液,加入 0.2g 紫脲酸铵混合指示剂,用 0.5 mol·L-1EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-= LaY-+2H+),消耗 EDTA 溶液 60.00mL。则产品中碳酸镧的质量分数 w=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是
A. 1mol-CH3中含有的质子数为10NA
B. H2O2+Cl2= 2HCl+O2反应中,每生成32gO2,转移2NA个电子
C. 3.6gCO和N2的混合气体含中子数为1.8NA
D. 6.2g白磷含有0.3 NA P-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明的妈妈在超市购买了面粉、牛肉、桔子和梅子蜜饯,要求小明根据所学知识说出每种食品中所含的一类营养物质。下面是小明的回答,其中错误的是
A. 面粉—淀粉 B. 牛肉—蛋白质
C. 桔子—维生素 D. 梅子蜜饯—防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aL NH3完全溶于1L水得到VmL氨水,溶液的密度为ρg/cm3(ρ<1),溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①![]() ②
②![]() ③
③![]() ④
④![]()
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.50ω
A. ①②④ B. ②③④ C. ②④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:

(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为___________

A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2mL D.①4.8mL、②小于4.8mL
(2)实验室需配制1mol·L-1的NaOH溶液200mL,在用托盘天平称取NaOH固体时,天平读数为________填代号,下同)。
A.大于8.0g B.小于8.0g C.8.0g
II.表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需_________g 10%(密度为1.01g/cm3)的氢氧化钠溶液
②量取:用_________mL量筒量取10%的氢氧化钠溶液
(2)把98%(密度为1.84g/cm3)的浓硫酸稀释成2mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸_______ mL
②下列实验操作使配制的溶液浓度偏的是__________
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏操作所用装置如图所示。写出装置中各仪器的名称(编号和名称要对应):

①酒精灯、②________、③铁架台、④________、⑤___________、⑥________________、⑦锥形瓶、⑧________。该装置中温度计的_________________要和蒸馏烧瓶________平齐,测得收集蒸气的温度,以确保收集到的馏分的纯净。冷凝水在_____口进水,_____口出水(填a或b),实验时要在蒸馏烧瓶中加入________________,防止液体暴沸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com