
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)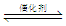 2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)
B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生
C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
今有两种盐的稀溶液,分别是a mol NaX溶液和b mol
NaX溶液和b mol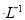 NaY溶液,下列说法不正确的是( )。
NaY溶液,下列说法不正确的是( )。
A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c (Y-)+c(HY) ;则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY
D.若两溶液等体积混合,测得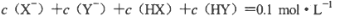
则可推出a+b=0.2 mol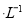
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:实验题
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液;
B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 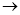
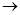
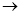 D
D 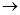 。
。
(2)操作E中的锥形瓶下垫一张白纸的作用是 。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是 。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是 。
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
实验①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀C中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+C1-(aq)
Ag+(aq)+C1-(aq)
B.滤液b中不含Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列化学方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ B.HS-+H2O
HCOO-+H3O+ B.HS-+H2O S2-+H3O+
S2-+H3O+
C.CO2+H2O HCO3-+H+ D.CO32-+H2O
HCO3-+H+ D.CO32-+H2O HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:填空题
能源短缺是人类社会面临的重大问题,世界各国都在努力寻找新能源,探求绿色能源的开发。甲醇是一种可再生能源,是一种污染性较小,热值较大的能源,因而具有广泛的开发价值和良好的应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
反应Ⅱ:
①上述反应符合“原子经济”原则的是_________(填“I’’或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)

由表中数据判断△H1_________0(填“>”、“=”或“<”),说明生成物的总能量一定_______(填“>”、“=”或“<”)反应物的总能量。
③反应Ⅱ反应历程如下图,回答下列问题;在反应体系中加入催化剂,反应速率增大,E1、E2和△H2的变化是:E1_________、E2_________、△H2_________(填“增大”“减小”“不变”)。

(2)最新研制的一种新型甲醇电池示意图如图,电池的两极分别充人甲醇和氧气(池内为酸性介质)。则电池工作时____________(填a或b)为正极,a极的电极反应式为______________。
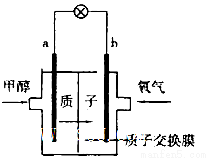
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
稀氨水中存在下述平衡: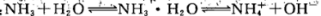 改变下列条件,能使电离程度增大的是
改变下列条件,能使电离程度增大的是
A.加浓氨水 B.升高温度 C.加NH4Cl溶液 D.加NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.碳酸钠、碳酸氢钠溶液都显碱性,且都可作为食用碱
B.人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外
C.我国居民传统膳食以糖类为主,淀粉、纤维素都是糖类物质
D.人造黄油里的反式脂肪酸对健康不利,它是液态植物油加氢时产生的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com