
分析 1、化学平衡计算的一般思路和方法:有关化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等.通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的关系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”.
2、化学反应速率v=$\frac{△c}{△t}$.
解答 (1)设2min内参与反应的B的物质的量为ymol,
3A(g)+B(g)?x C(g)+D(l),
开始(mol):3 2
反应(mol):3y y xy
平衡(mol):3-3y 2-y xy
由题意知:$\frac{3-3y}{2-y}$=$\frac{1}{2}$,解得y=0.8,由$\frac{2-0.8}{0.8x}$=$\frac{2}{4}$解得x=3;
故答案为:3;
(2)由(1)中计算可知,反应的A的物质的量为2.4mol,所以α=$\frac{2.4mol}{3mol}$×100%=80%
故答案为:80%;
(3)平衡时C的浓度c(C)=$\frac{2.4mol}{2L}$=1.2mol•L-1,所以以C表示的反应速率v=$\frac{△c(C)}{△t}$=$\frac{1.2mol•L-1}{2min}$=0.6 mol/(L•min);
故答案为:0.6 mol/(L•min)或0.01 mol/(L•s);
(4)平衡后气体的总物质的量为:0.6mol+1.2mol+2.4mol=4.2mol,开始时气体的总物质的量为5mol,所以平衡后与开始时气体压强的最简整数比为21:25
故答案为:21:25;
(5)在达到平衡的过程中,因为有液体生成,气体的总量减少,密闭容器的体积不变,所以气体的密度减小.
故答案为:减小.
点评 本题主要考察化学平衡、化学反应速率以及转化率等计算,题目综合性强,但知识点比较基础,稍有难度.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | B. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | C. | c(H+)•c(OH-) | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
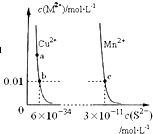
| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知三个反应如下:
已知三个反应如下:| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com