
����Ŀ����(Mo)����Ͻ���ұ��ũҵ�������������������������Ҫ�������Ź㷺��Ӧ�ú����õ�ǰ������Ϊ������һ����Ҫ��ԭ�ϺͲ��������ս�����ʡ������ƾ���(Na2MoO4 ��2H2O)��һ����Ҫ�Ľ�����ʴ����ij���������⾫��(��Ҫ�ɷ� MoS2 )�Ʊ������ƾ���ͽ������������ͼ��ʾ��

��ش��������⣺
(1)Na2 MoO 4��2H2O �� Mo �Ļ��ϼ��� ________��
(2)��֪�����ա������� MoS2 ��� MoO3�������� 1 �жԴ�������Ⱦ���� ________��
(3)����������������� Na2MoO4 �Ļ�ѧ����ʽ�� ________�����ᾧ���������ƾ����Ժ��������ʣ�Ҫ�õ��ϴ��ľ��壬��Ӧ��ȡ�ķ����� ________��
(4)����Һ������Ҫ�ɷ��� ________��
(5)�����˲����õ�������������и��±��գ�ʵ����ģ����±���ʱ����ʢ������������� ________��
(6)������±��յIJ����� Al �ڸ����·�����Ӧ�Ļ�ѧ����ʽ�� ________��
(7)��ü��Һ�в�������Ũ��Ϊ��c(MoO42��) =0.4 mol��L��1��c(SO42��) =0.02 mol��L��1���ᾧǰ�����������������ȥSO42���������Ǽ������������������Һ����ı仯����BaMoO4��ʼ����ʱ��SO42�� ��ȥ����Ϊ ________ (������λ��Ч����)�� [��֪�� Ksp(BaSO4)=1.1��10��10��Ksp(BaMoO4)=4.0��10��8]
���𰸡�+6 ��������� SO2 MoO3 + Na2CO3 =Na2MoO4 +CO2�� �ؽᾧ NaCl��HCl ���� 2Al+MoO3![]() Mo+Al2O3 94.5%��0.945
Mo+Al2O3 94.5%��0.945
��������
�⾫����Ҫ�ɷ���MoS2���Ʊ������Ƽ��Ʊ����������Ҫ���̣��⾫����������յõ������������β���ʹֲ�ƷMoO3������Na2CO3��Һ��Ӧ����Na2MoO4���ᾧ�����õ����壬Na2MoO4��Һ���������������ᣬ�������շֽ�����MoO3��MoO3�ڸ���������������ԭ���ɵ����⣬�Դ˽����⡣
��1��Na2 MoO 4��2H2O����Ԫ�ػ��ϼ�+1�ۣ���Ԫ�ػ��ϼ�2�ۣ�����Ԫ�صĻ��ϼ���x�ۣ����ݻ�����Ĵ�����Ϊ0��֪��2��(+1)+x+(2)��4=0�����x = +6��������õ���Ԫ�صĻ��ϼ���+6�ۣ�
�ʴ�Ϊ��+6��
��2����������������MoS2���MoO3,��S���������ɶԴ�������Ⱦ�����壬ӦΪSO2��
�ʴ�Ϊ�����������SO2��
��3������Na2CO3��Һ��MoO3��Ӧ���ɶ�����̼��Na2MoO4���䷴Ӧ�Ļ�ѧ����ʽΪ��MoO3 + Na2CO3 =Na2MoO4 +CO2 �������ᾧ���������ƾ����Ժ��������ʣ�Ҫ�õ��ϴ��ľ��壬Ӧ�����ؽᾧ��
�ʴ�Ϊ��MoO3 + Na2CO3 =Na2MoO4 +CO2 �����ؽᾧ��
��4������������ᣬ����H2MoO4��NaCl������Һ����Ҫ�ɷ�ΪNaCl��HCl��
�ʴ�Ϊ��NaCl��HCl��
��5�����չ��壬Ӧ�������н��У�
�ʴ�Ϊ��������
��6���������ȷ�Ӧ�ɻ��ս����⣬MoO3�������ȷ�Ӧ�Ļ�ѧ����ʽΪ��4Al+2MoO3 ![]() 2Mo+2Al2O3��
2Mo+2Al2O3��
�ʴ�Ϊ��4Al+2MoO3 ![]() 2Mo+2Al2O3��
2Mo+2Al2O3��
��7��Ksp(BaMoO4) = 4.0��108����������Һ��c(MoO42) = 0.4 molL1��BaMoO4��ʼ����ʱ����Һ�б����ӵ�Ũ��Ϊ��c(Ba2+) = ![]() = 1.0��107 mol/L����Ksp(BaSO4)=1.1��1010������Һ����������ӵ�Ũ��Ϊ��c(SO42) =
= 1.0��107 mol/L����Ksp(BaSO4)=1.1��1010������Һ����������ӵ�Ũ��Ϊ��c(SO42) = ![]() =1.1��103 mol/L����Ϊԭ��Һ����������ӵ�Ũ��Ϊ0.02 molL1��������������ӵ�ȥ����Ϊ��(1
=1.1��103 mol/L����Ϊԭ��Һ����������ӵ�Ũ��Ϊ0.02 molL1��������������ӵ�ȥ����Ϊ��(1![]() )��100%=15.5% = 94.5 %��0.945��
)��100%=15.5% = 94.5 %��0.945��
�ʴ�Ϊ��94.5 %��0.945��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��13 g C2H2(g)��ȫȼ������CO2��H2O(l)ʱ���ų�659 kJ��������д����ʾ������ȼ���ȵ��Ȼ�ѧ����ʽ___________________________��
��2����֪��Ӧ��Cl2��2HBr===Br2��2HCl��
��.����0.2 mol HCl����ʱ�ų�8.1 kJ��������
��.�������仯ʾ��ͼ��ͼ��

��÷�Ӧ���Ȼ�ѧ����ʽΪ_____________________________________�������������ж϶Ͽ�1 mol H��Cl ����Ͽ� 1 mol H��Br�������������ԼΪ________kJ��
��3����֪����2CO(g)��O2(g) ===2CO2(g)����H����566 kJ��mol��1
��Na2O2(s)��CO2(g) ===Na2CO3(s)��1/2O2(g)����H����226 kJ��mol��1
��CO(g)��Na2O2(s)��Ӧ�ų�509 kJ����ʱ������ת����ĿΪ________��
��4����֪CO ��H2 ��CH4 ��ȼ���ȷֱ�Ϊ283 kJ��mol��1��286 kJ��mol��1��890 kJ��mol��1������a mol CH4��CO��H2�Ļ��������ȫȼ��,����CO2�����Һ̬ˮ,��CO2��ˮ�����ʵ������ʱ,��ų�����(Q)��ȡֵ��Χ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100 ��ʱ�����ݻ�Ϊ2 L���ܱ������г���һ������X���壬�������·�Ӧ��X(g)��2Y(g)![]() Z(g)����Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����( )
Z(g)����Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����( )
��Ӧʱ��/min | n(X)/mol | n(Y)/mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
A. �¶�Ϊ200 ��ʱ��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ
B. ���ܱ���������ɱ䣬�����������䣬�ڴﵽƽ�����С�������Ϊԭ��һ�룬��c(X)��1 mol/L
C. ���������������䣬���������ٳ���1.00 mol X�����1.20 mol Y���壬����ƽ���Xת��������
D. ���������������䣬������������ͨ��0.10 mol X���壬0.10 mol Y��0.10 mol Z����v(��)��v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������п�ڼ�����Һ�еı仯��ͼ��ʾ��������Ϊ��Һ��pH��������ΪZn2����ZnO![]() �����ʵ���Ũ�ȵĶ���������˵����ȷ����(����)
�����ʵ���Ũ�ȵĶ���������˵����ȷ����(����)
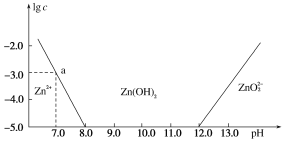
A. ��ͼ�����ݼ���ɵø��¶���Zn(OH)2���ܶȻ�(Ksp)��1��10��17
B. ��Һ�м���������ˮ��������Ӧ�����ӷ���ʽΪZn2����4OH��===ZnO![]() ��2H2O
��2H2O
C. Ϊ��ȡ��ҵ��Һ�е�Zn2�������Կ�����Һ��pH��13����
D. Zn2������Һ�еĴ�����ʽ��Al3�����ƣ�������Һ��ֻ��Zn(OH)2��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������廯����X��Y���Ǵ����Կ�ֲ������ȡ�����ϣ�X�ɰ���ͼ·�ߺϳ�Y��
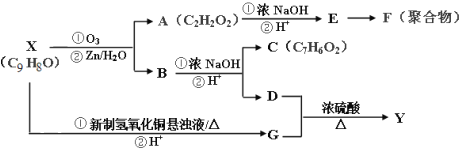
��֪����RCH=CHR�� ![]() RCHO+R��CHO
RCHO+R��CHO
�ڲ�����-��ԭ��(��ȩ��ֱ��������̼�ϵ���)��ȩ��Ũ��������ȩ��������ͬʱ���������뻹ԭ��Ӧ��������Ӧ������(�ڼ���Һ������������)�ʹ��ķ�Ӧ��
�磺2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X�Ĺ���������Ϊ_________________
(2)Y�Ľṹ��ʽΪ___________________
(3)D+G��Y���л���Ӧ����Ϊ��___________��
(4)�������ʲ�����D��Ӧ����_______(ѡ�����)��
a�������� b�������� c��̼������Һ d������
(5)д�����з�Ӧ����ʽ��X��G�ĵڢٲ���Ӧ__________________E��F��______________
(6)G�ж���ͬ���칹�壬д��ͬʱ��������������G������ͬ���칹��Ľṹ��ʽ(Ҫ���ǿռ������칹)
i���ܷ���������Ӧ ii���ܷ���ˮ�ⷴӦ iii��������ֻ��һ��ȡ����
(7)G��һ��ͬ���칹��H�Ľṹ��ʽΪ![]() ��д����
��д����![]() Ϊ�л�ԭ�ϣ���ȡH�ĺϳ�·��(����ѡ��ԭ��)__________________________________
Ϊ�л�ԭ�ϣ���ȡH�ĺϳ�·��(����ѡ��ԭ��)__________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С������ͼװ�ý���ʵ�飬�Իش��������⡣
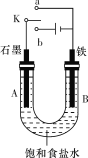
��1������ʼʱ����K��a���ӣ���A���ĵ缫��ӦʽΪ_____________________��
��2������ʼʱ����K��b���ӣ���B���ĵ缫��ӦʽΪ____________________��
��3������������þ���ֱ����ͼ��ʯī�����缫���������ҺΪ����������Һ����д��ԭ��ظ����ĵ缫��Ӧʽ_____________________________��
��4�����ö�����Ǧ��Ǧ���缫��������ҺΪ�������Һ����Ǧ���أ�����ʱ�����ĵ缫��Ӧʽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������û���ӦX+Y=W+Z����ʵ������֮���ת��
(1)��XΪMg��WΪC����ZΪ_________��
(2)��XΪSiO2��WΪCO���÷�Ӧ�ڹ�ҵ����;��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ͬѧ��ѧϰCl2��ʵ�����Ʒ������ü���Ũ������MnO2�����ķ�����Cl2���˷���Դ�ֲ������¶ȣ����������Ը�ʵ����иĽ�����֤Cl2�IJ������ʣ�����������̽�����
�������ϣ�KMnO4��KClO3�������Զ���MnO2ǿ���ڲ����ȵ������¼�����Ũ���ᷢ����Ӧ���Ӷ�ʵ����ȡCl2��Ŀ�ġ�
��1��ȷ����Ӧԭ����2KMnO4��16HCl(Ũ)===______��5Cl2����8H2O��
��2��ѡ��ʵ��װ�ã�������ͼ��ʾ��װ�ã�����ѡ�����е�____(�����)����ʵ�顣
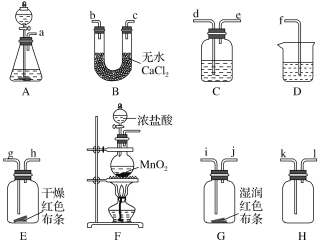
��3��װ�õ���ȷ����˳��Ϊ_______(��Сд��ĸ��ű�ʾ)��
��4����ʵ��ʱC����װҺ����________��
����������ǰ��������е�һ�������________��
��D����װҺ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�Ů��ѧ�������Ϸ���������(�����صĻ�ѧʽ��C15H22O5)������һ����������ű����ҩ�����������������˵����������ջ��ŵ����������ҽѧ������Ϊ�ҹ����ŵ������ѧ���ĵ�һ�ˡ����й��������ص������������(����)
A. �����ص�һ�������к���42��ԭ��
B. ��������̼Ԫ�ص���������ԼΪ63.8%
C. �����ص���Է�������Ϊ282
D. 0.1 mol�����ص�����Ϊ28.2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com