
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:选择题
| A. | 用浓溴水除去苯中的苯酚 | |
| B. | 除去苯中的少量甲苯,先用酸性高锰酸钾溶液,后用氢氧化钠溶液处理 | |
| C. | 在加热条件下,用乙醇除去乙酸乙酯中的乙酸 | |
| D. | 将溴乙烷和氢氧化钠溶液混合加热后,再加入硝酸银溶液,检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | “化学纯”是指这种硫酸只含H2SO4和H2O分子 | |
| D. | 配制460mL2.3mol•L-1的稀硫酸需量取该硫酸62.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
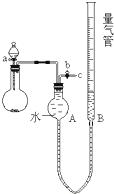 某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)
某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)| 制取的气体 | 药品 | 化学方程式 |
| O2 | H2O2MnO2 | 2H2O2═2H2O+O2↑ |
| H2 | 某溶液、Al | 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ |
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com