
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如图所示(无关物质已经略去):
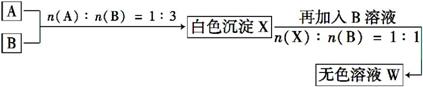

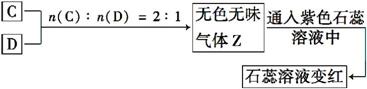
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为 、 。
(2)D溶液pH 7(填“大于”“小于”或“等于”),原因是(用离子方程式表示) 。
(3)等物质的量浓度的A、B、C、D溶液,pH由大到小的顺序是 (用化学式表示)。
(4)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(N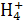 ):前者 后者(填“<”“>”或“=”)。
):前者 后者(填“<”“>”或“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是 。
由A、B混合产生沉淀,再加入B,沉淀溶解,推断A为AlCl3、B为NaOH,则X为Al(OH)3,W为NaAlO2。由B、C混合放出使石蕊变蓝的气体Y可推知C为NH4HSO4,则Y为NH3。由此可知D为Na2CO3,D与C反应可生成CO2气体。
(1)AlCl3溶液蒸干灼烧后得Al2O3,NaAlO2溶液蒸干灼烧得NaAlO2。
(2)Na2CO3在水中水解使溶液呈碱性,pH>7。
(3)分析四种物质的溶液的酸碱性可知pH大小顺序为NaOH>Na2CO3>AlCl3>
NH4HSO4。
(4)NH4HSO4溶液的酸性大于NH4Cl溶液,N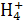 水解程度小,浓度大。
水解程度小,浓度大。
(5)B、C混合恰好完全反应时,溶质为Na2SO4、(NH4)2SO4,溶液呈弱酸性,若呈中性,则应NaOH稍过量。故离子浓度关系为c(Na+)>c(S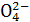 )>c(N
)>c(N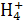 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
答案:(1)Al2O3 NaAlO2
(2)大于 C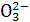 +H2O
+H2O HC
HC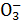 +OH-
+OH-
(3)NaOH>Na2CO3>AlCl3>NH4HSO4
(4)>
(5)c(Na+)>c(S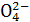 )>c(N
)>c(N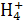 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)


科目:高中化学 来源: 题型:
最近科学家在-100 ℃的低温下合成了一种烃X,其核磁共振氢谱表明该分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型。下列说法中错误的是( )
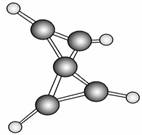 A.烃X的分子式为C5H4
A.烃X的分子式为C5H4
B.分子中碳原子的化学环境有2种
C.该有机物含有官能团
D.X分子中只有碳碳单键,没有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:
________________________________________________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g) === CH3OCH3(g) + H2O(g) △H1 == -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OH(g) === C2H4(g) + 2H2O(g) △H2 == -29.1 kJ·mol—1
乙醇异构化反应 C2H5OH(g) === CH3OCH3(g) △H3 == + 50.7 kJ·mol—1
则乙烯气相直接水合反应C2H4(g) + H2O(g)=== C2H5OH(g)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+ ==== CO2↑+ 2Cr3+ + 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+ ――― ____Cr3+ +____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7
恰好与9.6 mL 1.0 mol/L FeSO4溶液完全反应。
(3)请配平第②步中离子方程式(配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,完成以下有关问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:
① ;⑥ ;⑦ ;⑪ 。
(2)在这些元素中,最活泼的金属元素是 ;最活泼的非金属元素是 ;最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是 ;碱性最强的是 ;呈两性的氢氧化物是 ;写出三者之间相互反应的化学方程式
;
;
。
(4)在这些元素中,原子半径最小的是 ;原子半径最大的是 。
(5)④和⑧形成的化合物中含有的化学键类型是 ;其电子式为 。
(6)在⑧和⑫中,非金属性较强的是 ;写出能体现非金属性强弱的一个化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据反应原理设计的应用,不正确的是( )
A.C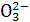 +H2O
+H2O HC
HC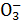 +OH-;用热的纯碱溶液清洗油污
+OH-;用热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3(胶体)+3H+;明矾净水
Al(OH)3(胶体)+3H+;明矾净水
C.TiCl4+(x+2)H2O(过量)  TiO2·xH2O↓+4HCl;制备TiO2纳米粉
TiO2·xH2O↓+4HCl;制备TiO2纳米粉
D.SnCl2+H2O Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制乙酸乙酯1 mL后,沿试管壁慢慢加入紫色石蕊溶液0.5 mL,这时石蕊溶液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡)。对可能出现的现象,叙述正确的是 ( )
A.石蕊层仍为紫色,有机层无色
B.石蕊层为三层环,由上而下呈红、紫、蓝三种颜色
C.石蕊层有两层,上层为紫色、下层为蓝色
D.石蕊层为三层环,由上而下呈蓝、紫、红三种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家宣称:普通盐水放在无线电波照射下可以燃烧,这一伟大的发现,有望解决用水作为人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述“结合力”实质是( )
A.分子间作用力 B.非极性共价键
C.氢键 D.极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的反应,不属于同一反应类型的是
| A | 甲烷和氯气光照制四氯化碳 | 乙酸和乙醇制乙酸乙酯 |
| B | 实验室由乙醇制乙烯 | 乙醇使酸性高锰酸钾溶液褪色 |
| C | 溴丙烷水解制丙醇 | 淀粉制葡萄糖 |
| D | 苯乙烯生成乙基环己烷 | 乙烯使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的Cl-物质的量与100ml 1 mol·L-1AlCl3溶液中Cl-相等的是
A.150ml 1 mol·L-1NaCl溶液 B.100ml 3mol·L-1KClO3溶液
C.75ml 2 mol·L-1MgCl2溶液 D.50ml 1 mol·L-1FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com