
【题目】实验室用氯气、海带为原料提取碘的实验装置:
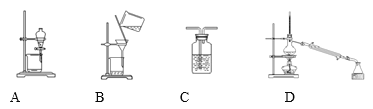
使用不当的是______(填选项字母);错误导致的主要后果是:________________
【答案】D 不能将碘单质与有机溶剂完全分离开
【解析】
在海带中碘元素以KI形式存在,先灼烧海带,使有机物变为气体逸出,然后过滤除去不溶性杂质,再向滤液中通入足量Cl2将碘置换出来,向得到的溶液中加入CCl4经萃取、分液,得到碘的CCl4溶液,最后根据I2、CCl4沸点的不同,通过蒸馏方法分离得到碘单质。为充分冷凝,要注意冷凝水通入方向是下进上出,注意结合碘单质易升华和氯气是有害气体,要进行尾气处理分析。
在海带中碘元素以KI形式存在,海带中含有可燃性有机物经灼烧变为CO2、H2O气体,然后经过滤后除去其中的不溶性杂质,而KI易溶于水,会进入水溶液中,然后向滤液中通入足量Cl2,发生置换反应:Cl2+2KI=2KCl+I2,将碘置换出来,反应产生的I2易溶于有机溶剂,而在水中溶解度小,所以向碘水中加入CCl4,充分振荡,经萃取、分液,得到碘的CCl4溶液,最后根据I2、CCl4沸点的不同,通过蒸馏方法分离得到碘单质。A是萃取分液,B是过滤,C是氧化KI产生碘单质。该实验中还可以用盛有NaOH溶液的C装置进行尾气处理,导气管是长进短出。D是分离碘和有机溶剂CCl4,但由于碘单质易升华,因此不能使用酒精灯直接加热,应水浴加热;且冷凝管没有通入冷凝水降温处理,这样就不能有效分离得到碘单质。冷凝水通入方向应该是下进上出,因此使用不当的是D。


科目:高中化学 来源: 题型:
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是( )
HCO3-+OH-。下列说法错误的是( )
A.加水稀释,溶液中所有离子的浓度都减小B.通入CO2,溶液pH减小
C.加入NaOH固体,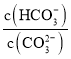 减小D.升高温度,平衡常数增大
减小D.升高温度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100mL的氯化钠溶液,当电路中通过1mole-时,阴阳两极产生的气体体积比为5:3,则原氯化钠溶液的物质的量浓度(mol/L)为( )
A.4B.2C.1D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为_____;1mol C22-中含有的![]() 键数目为________。
键数目为________。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为___。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为___________。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A具有如下性质:
的有机物A具有如下性质:![]() 在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;
在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;![]() 在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;
在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;![]() 在浓硫酸作用下,能生成一种分子式为
在浓硫酸作用下,能生成一种分子式为![]() 的五元环状化合物E。下列叙述正确的是
的五元环状化合物E。下列叙述正确的是 ![]()
![]()
A.A的结构简式为![]()
B.C与D互为同系物
C.A转化为B的反应属于取代反应
D.B与E互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某可逆反应达到平衡,其平衡常数为K= ![]() ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
A.该反应的化学方程式为CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ;②
;②![]() ;③(CH3)3C–CHBr2;④CHCl2–CHBr2;⑤
;③(CH3)3C–CHBr2;④CHCl2–CHBr2;⑤![]() ;⑥CH3Cl
;⑥CH3Cl
A.全部B.②④C.①③⑥D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围_____;
(2)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=_____(lg2=0.3、lg3=0.477、lg5=0.7)
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液pH=______
Ⅱ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)_____→_____→_____→D→_____。
(2)D步骤中尖嘴部分应_____________________。
(3)滴定终点时锥形瓶中颜色变化____________。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?_____(填“偏高”、“偏低”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com