
����Ŀ����֪���ᡢ��ˮ���ܶ�������ˮ�����Ĺ�ϵ��ͼ��ʾ�����������백ˮ��һ�ݣ�����ݱ�����Ϣ���ش��������⣺
���ʵ����ʵ���Ũ��/molL��1 | ��Һ���ܶ�/gcm��3 | |
���� | c1 | ��1 |
��ˮ | c2 | ��2 |

��1�������������������Ϊ����д��λ���ú�c1����1 �� �Ĵ���ʽ��ʾ����
��2�����ʵ���Ũ��Ϊc1molL��1��������ˮ�������ϣ���Ϻ���Һ������仯���Բ��ƣ���������Һ�����ʵ���Ũ��ΪmolL��1 ��
��3�������ʵ���Ũ�ȷֱ�Ϊc2molL��1�� ![]() c2molL��1�İ�ˮ��������ϣ�������Һ���ܶ�������ڡ�����С�ڡ����ڡ�����ͬ����2gcm��3 �� ������Һ�����ʵ���Ũ��
c2molL��1�İ�ˮ��������ϣ�������Һ���ܶ�������ڡ�����С�ڡ����ڡ�����ͬ����2gcm��3 �� ������Һ�����ʵ���Ũ�� ![]() c2molL��1�����Ϻ���Һ������仯���Բ��ƣ�
c2molL��1�����Ϻ���Һ������仯���Բ��ƣ�
���𰸡�
��1��![]()
��2��0.5c1
��3�����ڣ�����
���������⣺��1������c= ![]() ���й�ʽ��֪�����������������=
���й�ʽ��֪�����������������= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2����������ˮ�����ΪVL�����Ϻ���Һ�������Ϊ2VL������ϡ�Ͷ��ɣ�ϡ��ǰ��������������ʵ������䣬ϡ�ͺ�������Һ��Ũ��Ϊ
����2����������ˮ�����ΪVL�����Ϻ���Һ�������Ϊ2VL������ϡ�Ͷ��ɣ�ϡ��ǰ��������������ʵ������䣬ϡ�ͺ�������Һ��Ũ��Ϊ ![]() =0.5c1mol/L�����Դ��ǣ�0.5c1����3��c2molL��1�İ�ˮ��
=0.5c1mol/L�����Դ��ǣ�0.5c1����3��c2molL��1�İ�ˮ�� ![]() c2molL��1�İ�ˮ��������ϣ���Ϻ���Һ��Ũ��С��c2molL��1�İ�ˮ����ͼ��֪����ˮ��Ũ��Խ���ܶ�ԽС���ʻ�Ϻ���Һ���ܶȴ��ڦ�2gcm��3 ��
c2molL��1�İ�ˮ��������ϣ���Ϻ���Һ��Ũ��С��c2molL��1�İ�ˮ����ͼ��֪����ˮ��Ũ��Խ���ܶ�ԽС���ʻ�Ϻ���Һ���ܶȴ��ڦ�2gcm��3 ��
���ʵ���Ũ�ȷֱ�Ϊc2molL��1�� ![]() c2molL��1�İ�ˮ��������ϣ���c2molL��1��
c2molL��1�İ�ˮ��������ϣ���c2molL��1�� ![]() c2molL��1�İ�ˮ������ֱ�ΪaL��bL����Ϻ���Һ�����Ϊ��a+b��L����Ϻ�ˮ�����ʵ���Ũ��Ϊ
c2molL��1�İ�ˮ������ֱ�ΪaL��bL����Ϻ���Һ�����Ϊ��a+b��L����Ϻ�ˮ�����ʵ���Ũ��Ϊ ![]() =c2+
=c2+ ![]() =c2��
=c2�� ![]() ����ˮ��Ũ��Խ���ܶ�ԽС������V=
����ˮ��Ũ��Խ���ܶ�ԽС������V= ![]() ��֪a��b����
��֪a��b���� ![]() ��
�� ![]() c2 �� ��c2��
c2 �� ��c2�� ![]() ��
�� ![]() c2 ��
c2 ��
���Դ��ǣ����ڣ����ڣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��һ����Ҫ�Ļ���ԭ�ϣ�������������֪ʶ����������⣮
��1�����������ĸ�ƿ��Ӧ���ı�ǩΪ ��
A.��ʴƷ
B.��ըƷ
C.�ж�Ʒ
D.��ȼƷ
��2����ҵ�Ͻ�����ͨ��ʯ������ȡƯ�ۣ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
��3��Ư�۵���Ч�ɷ��ǣ��ѧʽ�� ��
��4��ʵ���ҿ�����KMnO4��Ũ�����ڳ������Ʊ�Cl2 �� ���������Һ���������ʵĶ��Լ����붨��������ij��ѧ��ȤС����ʵ����������KMnO4����������500mL 0.1mol/L��KMnO4��Һ�������õ�������������ƽ��ҩ�ס��ձ�������������Ͳ����ͷ�ιܡ� ��
�����в����ᵼ��ʵ����ƫС����������ĸ����
a��ת��ʱû��ϴ���ձ���������
b������ƿ�ڱڸ���ˮ���δ���ﴦ��
c���ߵ�ҡ�Ⱥ��ְ�Һ����ڿ̶����ּ�ˮ����
d����ˮ����ʱ���ӿ̶���
������õĸ�Ũ�ȵ�KMnO4��Һ��300mL 0.2mol/L��KI��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3 �� ������KMnO4�����ΪmL������֪MnO4���ڴ���������ԭΪMn2+��
��5����ˮ�к��ж��ֳɷ֣�������кܶ����ʣ�������ˮ�ֱ�����ͼ�������ʷ����ķ�Ӧ��գ�a��b��c��d�غϲ��ִ������ʼ䷴Ӧ������ˮ��������֪��Cl2+2Br��=2Cl��+Br2 ��������֤����ˮ����Ư���Ե������a������b������c����d�����������ǣ���a�з�����Ӧ�����ӷ���ʽ�ǣ�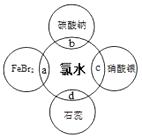
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶ȣ����г����в�һ��������ǣ�
A. ���볣��Ka B. ��ѧƽ�ⳣ��K
C. ˮ�����ӻ�����Kw D. �ε�ˮ�ⳣ��Kh
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪̼�����ֳ�����ͬλ�أ�12C��13C��14C����Ҳ������ͬλ�أ�16O��17O��18O���������������ɵĶ�����̼��������У� ��
A. 8��B. 12��C. 18��D. 24��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Ҫ�Ļ���ԭ�ϣ�Ҳ��Ӧ�ù㷢�Ļ�����Ʒ��CO2��������ƻ������ط�Ӧ�ɲ���������
������м��㣺
��1��CO2ͨ�백ˮ����NH4HCO3 �� NH4HCO3�����ֽ⣮2.00mol NH4HCO3��ȫ�ֽ⣬�ֽ���ᆳ���������ΪL����״������
��2��ijH2�к���2.40molCO2 �� �û������ͨ��2.00L NaOH��Һ�У�CO2����ȫ���գ����NaOH��ȫ��Ӧ����NaOH��Һ��Ũ��Ϊ ��
��3��CO2��KO2�����з�Ӧ��
4KO2+2CO2��2K2CO3+3O2
4KO2+4CO2+2H2O��4KHCO3+3O2
��9mol CO2���ܷ���ں�KO2��Ӧ������9mol O2 �� ��Ӧǰ�ܷ����H2O����Ӧ���Ƕ��٣���ʽ���㣮
��4�������ˮ������Ӧ�IJ����Ǻϳɼ״���ԭ�ϣ�CH4+H2O ![]() CO+3H2 �� ��֪��CO+2H2
CO+3H2 �� ��֪��CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O��300mol CH4��ȫ��Ӧ��IJ����У�����100mol CO2��ϳɼ״�������ü״�350mol����������120mol������CO2��ת���ʣ�
CH3OH+H2O��300mol CH4��ȫ��Ӧ��IJ����У�����100mol CO2��ϳɼ״�������ü״�350mol����������120mol������CO2��ת���ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.40mol NO2�������2L���ܱ������У��������·�Ӧ��2NO2��g��N2O4��g����H��0����ⷴӦ���������ݣ�����˵����ȷ���ǣ� ��
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
A.0��20 s�ڣ�v��NO2��=0.005 mol?L��1?s��1
B.59 sʱ��c��NO2��һ������0.12 mol?L��1
C.��������ʼʱ����NO2��������0.80 mol����÷�Ӧ��ƽ�ⳣ��K�� ![]()
D.��������Ӧ��120��ʱ���У���Ӧ��80 sʱ��n��N2O4����0.08 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������AgCl(s)�ֱ����ӵ�����������Һ�У�������Һc��Ag+����С����
A.10 mL 0.4mol��L-1������B.10 mL 0.3mol��L-1MgCl2��Һ
C.10 mL 0.5mol��L-1NaCl��ҺD.10 mL 0.1mol��L-1AlCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��ԭ������������������ֶ�����Ԫ�أ�W����̬�⻯����ʹ��ɫʯ����Һ������W��X����Ԫ�ص�����������ˮ���������Y�������������Ӧ��W��X��Y��Z������������֮��Ϊ16��
��1��W���ʵĵ���ʽ�� ��
��2�����û�ѧ�������W����̬�⻯����ʹ��ɫʯ����Һ������ԭ�� ��
��3����֪AsԪ�ص�ԭ������Ϊ33����W��ͬһ���壬As��Ԫ�����ڱ��е�λ���� ��
��4��W������������ˮ������Y�������������Ӧ�����ӷ���ʽ��
��5��X��Z�ĵ���֮�䷢����Ӧ�Ļ�ѧ����ʽ�� ��
��6����֪Q��Z��λ���������ڵ�ͬ����Ԫ�أ�ij�¶��£�����Ԫ�ص���̬������H2�������Ϸ�Ӧ������̬�⻯���ƽ�ⳣ���ֱ�ΪKQ=5.6��107 �� KZ=9.7��1012 �� Q��Ԫ�ط����� �� ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ�ɷ�FeS2������������̷���FeSO47H2O���Ĺ�ҵ����ʾ��ͼ��ͼ�� 
��1������¯�У���������з��鴦����Ŀ���� ��
��2���Ӵ����У���������Ҫ��Ӧ��SO2��O2�ķ�Ӧ���仯ѧ����ʽ�� ��
��3����Ӧ���У�����������Ӧת��Ϊ��ҺI���壮
�������е�FeS�ڷ�Ӧ�����������������ԭ������
����ҺI���������ʵĻ�ѧʽ�� ��
��4������a����Ҫ�����ǣ�����Ũ����������ϴ�ӣ�
��5�������У�����X����ѡ��������FeS2������������XΪ������FeS2��ʱ������ҺI�����X������Ӧ�����ӷ���ʽ����������
FeS2++�TFe2++SO42��+ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com