
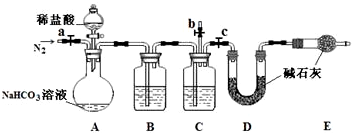
NaHCO3在水溶液中,HCO3-的电离程度小于HCO3-的水解程度。回答下列有关问题:
⑴H2CO3的电离方程式为 ;
⑵NaHCO3溶液显碱性,原因是(用离子方程式表示)
;
⑶在该溶液中,c(Na+)、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)= ;
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)= 。
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却至 50℃ | pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CaC2的电子式: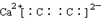 | B、中子数为18的氯原子结构示意图: | C、聚乙炔的结构简式: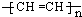 | D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉有效成分的化学式:CaClO | ||
B、Na+的结构示意图: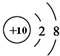 | ||
C、原子核内有10个中子的氧原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com