
在无机化工中,硫酸亚铁铵[(NH4)2Fe(SO4)2]是制取其它铁系化合物的原料,如制取氧化伯系颜料、磁性材料和黄血盐等。某化学兴趣小组设计如下实验方案,探究(NH4)2Fe(SO4)2完全分解的产物。
已知:①隔绝空气受热完全分解是氧化还原反应。
②98%浓硫酸能顺利吸收SO3。
Ⅰ.甲同学根据以下流程探究分解的部分产物,试回答下列问题:
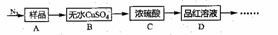
(1)B装置预期的现象是_____;C装置的作用可能是______,D装置可以检验分解产物中是否含有_____。
(2)加热前先通一会儿N2,再关闭气阀,其目的是_______。
Ⅱ.乙同学猜想(NH4)2Fe(SO4)2分解时可能生成了SO3,为了验证他的猜想,小组同学又提供了如右图装置,试回答下列问题:
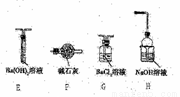
(3)不能选择E和F装置的原因是________。
(4)加热装置A与G、H连接并进行实验,请你提出需要改进的方案________。
(5)已知饱和SO2水溶液中c(SO32-)=6.0×10-8mol•L-1,Ksp(BaSO3)=5.4×10-7。通过计算判断在1.0mol•L-1的BaCl2溶液中,通入足量纯净的SO2能否生成BaSO3沉淀?
(6)当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是_______;为了进一步证明是否有SO3生成,请你补充实验方案(不要求写具体的操作过程)_________。
 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源:2015-2016学年江西省高二上二次月考化学试卷(解析版) 题型:填空题
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月月考化学试卷(解析版) 题型:选择题
在自然界中有很多循环过程,其中部分无机物循环过程如下图,则下列说法不正确的是( )
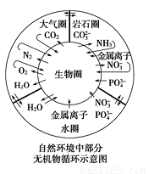
A.金属离子和硝酸根离子进入生物圈可能形成环境污染
B.碳元素在自然界中的循环主要是通过CO2的生成和消耗来实现的
C.自然界中不存在硫及其化合物的循环,因为在示意图中没能体现
D.雷雨天氮气和氧气的反应属于自然固氮的一种方式
查看答案和解析>>
科目:高中化学 来源:2016届吉林长春外国语学校高三上第一次质检化学试卷(解析版) 题型:选择题
有机物甲的分子式为C5H10O2,已知:①甲可以发生银镜反应;②甲是具有水果香味的物质;③在酸性或碱性条件下甲可以发生水解反应;则甲的可能结构有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
将5.6g铁投入浓硝酸溶液中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为
A.1120mL B.2240mL C.336mL D.4480mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川唐徕回民中学高一上10月化学卷(解析版) 题型:计算题
将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)6.50g锌的物质的量;
(2)反应中生成的H2在标准状况下的体积.
(3)所用盐酸中HCl中的物质的量浓度;
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )
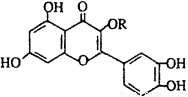
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第三次月考化学试卷(解析版) 题型:选择题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X 是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法的是不正确的是
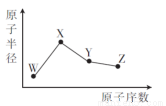
A.简单离子半径:W>X>Z
B.最简单气态氢化物的稳定性:Y<Z
C.化合物XZW中既含离子键又含共价键
D. Y的氧化物能与X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:填空题
AX(g)+2X2(g) AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
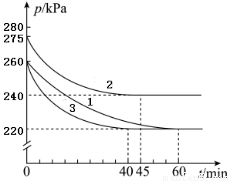
(1)计算实验1反应开始至达到平衡时的反应速率v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为______(填实验序号);
与实验1相比,其他两组改变的实验条件及判断依据是:2____________,3_________。
(3)用p1表示开始时总压强,p2表示平衡时总压强,α表示AX的平衡转化率,则α的表达式为____________;实验1和2的平衡转化率:α1为___________,α2为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com