
+ 4 |
2- 3 |
2- 3 |
2- 4 |
- 2 |
- 3 |

| 0.4+2×0.3+3×0.1+0.1 |
| 2 |


科目:高中化学 来源: 题型:
| A、H2SO4的摩尔质量是98g |
| B、1mol H2O的质量是18g/mol |
| C、Cl2的摩尔质量是35.5g/mol |
| D、1mol N2的质量是28g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
如图,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 25 | 50 | 95 | |
| 溶解度(g) | 氯化钠 | 36.0 | 37.0 | 39.0 |
| 苯甲酸 | 0.17 | 0.95 | 6.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
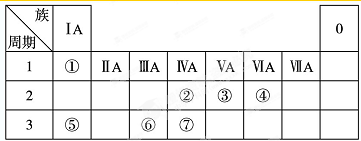
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HI<HBr<HCl<HF |
| B、原子半径:K>Cl>S |
| C、分子稳定性:HF>HCl>HBr>HI |
| D、单质熔点:Li<Na<K<Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- |
| B、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- |
| C、使石蕊溶液变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- |
| D、pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com