
分析 (1)镁离子与氢氧化钠反应生成氢氧化镁沉淀,所以检验的是氯化镁;碳酸钠与钙离子反应生成碳酸钙沉淀,加入碳酸钠是用于检验氯化钙;
(2)在溶解、蒸发、过滤操作中都会用到玻璃棒,在溶解样品时使用玻璃棒搅拌,以便加速溶解;蒸发滤液时用玻璃棒搅拌,使液体受热均匀;
(3)粗盐中含有氯化钙,需要加入碳酸钠溶液,反应生成碳酸钙沉淀,从而除去杂质钙离子;移入蒸发皿蒸发前,要除去多余的碳酸钠和氢氧化钠;
(4)根据存在步骤可知,A为碳酸钙沉淀,而B中含有反应生成的氯化钠.
解答 解:(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀,故加入氢氧化钠溶液的目的是检验溶液中是否含有MgCl2;
氯化钙与碳酸钠反应生成碳酸钙沉淀,则加入碳酸钠溶液的目的是检验溶液中是否含有CaCl2,
故答案为:MgCl2;CaCl2;
(2)②③⑤的步骤分别为溶解、过滤和蒸发操作,三种操作中都使用到玻璃棒,它在步骤②和⑤的操作方法都是搅拌,但目的不同,在步骤②的目的是加速固体的溶解,步骤⑤的目的是使液体受热均匀,避免液体飞溅,
故答案为:玻璃棒;加速溶解;使液体受热均匀,防止液体飞溅;
(3)已知粗盐溶液中含有氯化钙,即含有杂质钙离子,应该加入碳酸钠溶液除去,其反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;前面除杂质时加入过量的碳酸钠和氢氧化钠,移入蒸发皿蒸发前,要除去多余的碳酸钠和氢氧化钠,所以要加过量的稀盐酸;
故答案为:碳酸钠溶液;Na2CO3+CaCl2=CaCO3↓+2NaCl;加过量的稀盐酸;
(4)A为反应生成碳酸钙的质量,可以据此计算出氯化钙的质量,从而计算出氯化钠的质量分数;而B中含有新生成的氯化钠,无法计算氯化钠的质量分数,所以步骤⑥中需要称量的是A的质量,
故答案为:A; B中含有反应生成的氯化钠.
点评 本题考查了粗盐的提纯方法、性质实验方案的设计与评价,题目难度不大,注意掌握物质分离与提纯方法,正确理解提纯原理为解答本题的关键,试题有利于培养学生的分析、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
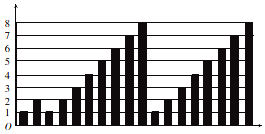
| A. | 横坐标为质子数,纵坐标为元素的最高正价 | |
| B. | 横坐标为原子序数,纵坐标为元素原子的最外层电子数 | |
| C. | 横坐标为核电荷数,纵坐标为元素原子的半径 | |
| D. | 横坐标为中子数,纵坐标为元素的非金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
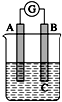 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A. | A是Zn,B是Cu,C为稀硫酸 | B. | A是Cu,B是Zn,C为稀硫酸 | ||
| C. | A是Fe,B是Ag,C为稀AgNO3溶液 | D. | A是Ag,B是Fe,C为稀AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
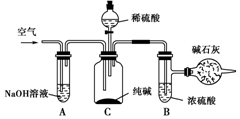 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量.
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
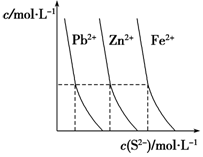 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:
高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com