
”¾ĢāÄæ”æ(1)ŅŃÖŖ£ŗ¢ŁFe(s)+![]() O2(g)=FeO(s) H1=-272.0kJ/mol
O2(g)=FeO(s) H1=-272.0kJ/mol
¢Ś2Al(s)+![]() O2(g)=Al2O3(s) H1=-1675.7kJ/mol
O2(g)=Al2O3(s) H1=-1675.7kJ/mol
AlŗĶFeO·¢ÉśĀĮČČ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ__________________”£Ä³Ķ¬Ń§ČĻĪŖ£¬ĀĮČČ·“Ó¦æÉÓĆÓŚ¹¤ŅµĮ¶Ģś£¬ÄćµÄÅŠ¶ĻŹĒ_____(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)£¬ĄķÓÉŹĒ________”£
(2)·“Ó¦ĪļÓėÉś³ÉĪļ¾łĪŖĘųĢ¬µÄijæÉÄę·“Ó¦ŌŚ²»æÉĢõ¼žĻĀµÄ·“Ó¦Ąś³Ģ·Ö±šĪŖA”¢BČēĶ¼ĖłŹ¾”£
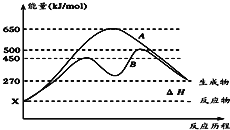
¢Ł¾ŻĶ¼ÅŠ¶ĻøĆ·“Ó¦ŹĒ_______(Ģī”°Īü”±»ņ”°·Å”±)ČČ·“Ó¦”£
¢ŚĘäÖŠBĄś³Ģ±ķĆ÷“Ė·“Ó¦²ÉÓƵÄĢõ¼žĪŖ________(Ģī×ÖÄø)”£
A.ÉżøßĪĀ¶Č B.Ōö“ó·“Ó¦ĪļµÄÅØ¶Č C.½µµĶĪĀ¶Č D.Ź¹ÓĆ“ß»Æ¼Į
(3)ĀĮČČ·ØŹĒ³£ÓĆµÄ½šŹōĄäĮ¶·½·ØÖ®Ņ»”£ŅŃÖŖ£ŗ
4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
Mn(s)+O2(g)=MnO2(s)H=-521kJ/mol
AlÓėMnO2·“Ó¦Ņ±Į¶½šŹōMnµÄČČ»Æѧ·½³ĢŹ½ŹĒ___________________”£
(4)ÖŠ¹śĘųĻó¾ÖµÄŹż¾ŻĻŌŹ¾£¬2013ÄźĘó¹śĘ½¾łĪķö²ĢģŹżĪŖ52ÄźĄ“Ö®×ī”£ŠĪ³ÉĪķö²µÄÖ÷ŅŖ³É·ÖĪŖÉś²śÉś»īÖŠÅŷŵķĻĘų£¬Ęū³µĪ²Ęų¼°Ńļ³¾µČ”£ÓĆCH4æÉŅŌĻū³żĘū³µĪ²ĘųÖŠµŖŃõ»ÆĪļµÄĪŪČ¾”£
ŅŃÖŖ£ŗCH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
2NO2(g)=N2O4(g) H=-56.9kJ/mol
Š“³öCH4“߻ƻ¹ŌN2O4(g)Éś³ÉN2ŗĶH2O(l)µÄČČ»Æѧ·½³ĢŹ½________________”£
”¾“š°ø”æ 2Al£Øs£©+3FeO£Øs£©£½Al2O3£Øs£©+3Fe£Øs£©H=-859.7kJ/mol ²»ÄÜ øĆ·“Ó¦ŠčŅŖŅż·¢£¬ŠčŅŖĻūŗÄ“óĮæÄÜĮ棬³É±¾½Ļøß Īü D 4A1(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)H=-1789kJ/mol CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)H=898.1kJ/mol
”¾½āĪö”æ£Ø1£©øł¾ŻøĒĖ¹¶ØĀɼĘĖć”÷H£¬øĆ·“Ó¦ŠčŅŖŅż·¢£¬³É±¾¹żøߣ»
£Ø2£©¢ŁÓÉĶ¼æÉÖŖ£¬·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮ棬øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£»
¢ŚÓÉĶ¼æÉÖŖ£¬·“Ó¦Ąś³ĢBÓėAĻą±Č£¬øı䷓ӦĄś³Ģ£¬Ó¦ŹĒŹ¹ÓĆ“ß»Æ¼Į£»
£Ø3£©øł¾ŻøĒĖ¹¶ØĀɼĘĖć”÷H£»
£Ø4£©øł¾ŻøĒĖ¹¶ØĀɼĘĖć”÷H”£
£Ø1£©ŅŃÖŖ£ŗ¢ŁFe(s)+1/2O2(g)=FeO(s) H1=-272.0kJ/mol
¢Ś2Al(s)+3/2O2(g)=Al2O3(s) H1=-1675.7kJ/mol
½«·½³ĢŹ½¢Ś-¢Ł”Į3µĆ2Al£Øs£©+3FeO£Øs£©£½Al2O3£Øs£©+3Fe£Øs£©”÷H=-1675.7kJmol-1-£Ø3”Į-272.0kJmol-1£©=-859.7 kJmol-1£»
ĀĮČČ·“Ó¦ŠčŅŖĆ¾Č¼ÉÕŅż·¢£¬ĻūŗĽĻ¶ąÄÜĮ棬³É·Ö¹żøߣ¬Ņņ“Ė²»ÄÜÓĆÓŚ¹¤ŅµĮ¶Ģś£»
£Ø2£©¢ŁÓÉĶ¼æÉÖŖ£¬·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮ棬øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£»
¢ŚÓÉĶ¼æÉÖŖ£¬·“Ó¦Ąś³ĢBÓėAĻą±Č£¬øı䷓ӦĄś³Ģ£¬×īŗó“ļµ½ĻąĶ¬µÄĘ½ŗāדĢ¬£¬øıäµÄĢõ¼žÓ¦ŹĒŹ¹ÓĆ“ß»Æ¼Į£¬½µµĶ·“Ó¦µÄ»ī»ÆÄÜ£¬¼Óæģ·“Ó¦ĖŁĀŹ£¬“š°øĪŖD£»
£Ø3£©ŅŃÖŖ£ŗ¢Ł4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
¢ŚMn(s)+O2(g)=MnO2(s) H=-521kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉæÉÖŖ¢Ł£¢Ś”Į3¼“µĆµ½AlÓėMnO2·“Ó¦Ņ±Į¶½šŹōMnµÄČČ»Æѧ·½³ĢŹ½ŹĒ4A1(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)H=-1789kJ/mol”£
£Ø4£©ŅŃÖŖ£ŗ¢ŁCH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
¢Ś2NO2(g)=N2O4(g) H=-56.9kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉæÉÖŖ¢Ł£¢Ś¼“µĆµ½CH4“߻ƻ¹ŌN2O4(g)Éś³ÉN2ŗĶH2O(l)µÄČČ»Æѧ·½³ĢŹ½CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)H=898.1kJ/mol”£


 ÄÜæ¼ŹŌĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
ÄÜæ¼ŹŌĘŚÄ©³å“Ģ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. “óĆ×ø»ŗ¬µķ·Ū
B. ¼ÓµāŹ³ŃĪŗ¬ÓŠµāĖį¼Ų(KIO3)
C. ČĖĢå±ŲŠčµÄĪ¢ĮæŌŖĖŲ¾ĶŹĒĪ¬ÉśĖŲ
D. ČĖĢå±ŲŠčµÄĪ¢ĮæŌŖĖŲ²»¶¼ŹĒ½šŹōŌŖĖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠČČ»ÆѧŹ½ÖŠ£¬ÕżČ·µÄŹĒ£Ø””””£©
A.¼×ĶéµÄČ¼ÉÕČČĪŖ 890.3 kJmol©1 £¬ Ōņ¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗCH4£Øg£©+2O2£Øg£©=CO2£Øg£©+2H2O£Øg£©”÷H=©890.3 kJmol©1
B.500”ę”¢30MPa ĻĀ£¬½« 0.5mol N2ŗĶ 1.5molH2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³É NH3£Øg£©£¬·ÅČČ 19.3 kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2+3H2£Øg£© ![]() 2NH3£Øg£©”÷H=©38.6 kJmol©1
2NH3£Øg£©”÷H=©38.6 kJmol©1
C.Ļ”ŃĪĖįŗĶ Ļ”ĒāŃõ»ÆÄĘČÜŅŗ»ģŗĻ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗH+£Øaq£©+OH©£Øaq£©=H2O£Øl£©”÷H=©57.3 kJmol©1
D.1molH2ĶźČ«Č¼ÉÕ·ÅČČ 142.9kJ£¬ŌņĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=+285.8 kJmol©1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆĤ¼¼ŹõŌĄķŗĶµē»ÆѧŌĄķÖʱøÉŁĮæĮņĖįŗĶĀĢÉ«Ļõ»Æ¼ĮN2O5£¬×°ÖĆČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

A. µē¼«aŗĶµē¼«c¶¼·¢ÉśŃõ»Æ·“Ó¦
B. µē¼«dµÄµē¼«·“Ó¦Ź½ĪŖ2H++2e-=H2”ü
C. cµē¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖN2O4-2e-+H2O=N2O5+2H+
D. ×°ÖĆAÖŠĆæĻūŗÄ64gSO2£¬ĄķĀŪÉĻ×°ÖĆAŗĶ×°ÖĆBÖŠ¾łÓŠ2moH+ĶعżÖŹ×Ó½»»»Ä¤
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬Ļņ2LŗćČŻČŻĘ÷ÖŠ³äČė1molAŗĶ1molB£¬·¢Éś·“Ó¦A£Øg£©+B£Øg£©=C£Øg£©¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā£¬·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾ŻČē±ķ£®ĻĀ¶ŌĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
t/s | 0 | 5 | 15 | 25 | 35 | |
n£ØA£©/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.Ē° 5 s µÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØA£©=0.03 molL©1s©1
B.Õż·“Ó¦ŹĒĪüČČ·“Ó¦
C.±£³ÖĪĀ¶Č²»±ä£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2molC£¬“ļĘ½ŗāŹ±£¬CµÄ×Ŗ»ÆĀŹ“óÓŚ80%
D.±£³ÖĪĀ¶Č²»±ä£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė0.2molA£¬0.2molBŗĶ1molC£¬·“Ó¦“ļµ½Ę½ŗāĒ°v£ØÕż£©£¼v£ØÄę£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢YĮ½ŌŖĖŲæÉŠĪ³ÉXY3ŠĶ¹²¼Ū»ÆŗĻĪļ£¬ŌņX”¢Y×īĶā²ćµÄµē×ÓÅŲ¼æÉÄÜŹĒ(””””)
A. X£ŗ3s23p2””Y£ŗ3s23p5 B. X£ŗ2s22p3””Y£ŗ2s22p4
C. X£ŗ3s23p1””Y£ŗ2s22p5 D. X£ŗ2s22p3””Y£ŗ1s1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×”¢ŅŅĮ½³Ųµē¼«²ÄĮĻ¶¼ŹĒĢś°ōÓėĢ¼°ō(ČēĶ¼)”£Öī»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©ČōĮ½³ŲÖŠ¾łŹ¢·ÅCuSO4ČÜŅŗ£¬·“Ó¦Ņ»¶ĪŹ±¼äŗó£ŗ
¢ŁÓŠŗģÉ«ĪļÖŹĪö³öµÄŹĒ£ŗ¼×³ŲÖŠµÄ_____°ō£»ŅŅ³ŲÖŠµÄ____°ō”£
¢ŚŌŚŅŅ³ŲÖŠŃō¼«µÄµē¼«·“Ó¦ŹĒ____________”£
£Ø2£©ČōĮ½³ŲÖŠ¾łŹ¢·Å±„ŗĶNaClČÜŅŗ”£
¢ŁŠ“³öŅŅ³ŲÖŠ×Ü·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ___________________”£
¢Ś½«ŹŖČóµÄµķ·ŪKIŹŌÖ½·ÅŌŚŅŅ³Ųø½½ü£¬·¢ĻÖŹŌÖ½±äĄ¶£¬“żŅ»¶ĪŹ±¼äŗóÓÖ·¢ĻÖĄ¶É«ĶŹČ„£¬ÕāŹĒŅņĪŖ¹żĮæµÄCl2½«Éś³ÉµÄI2Ńõ»Æ”£Čō·“Ó¦µÄCl2ŗĶI2µÄĪļÖŹµÄĮæÖ®±ČĪŖ5:1£¬ĒŅÉś³ÉĮ½ÖÖĖį”£øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ½ŗĢåµÄĖµ·ØÕżČ·µÄŹĒ £Ø £©
A.½ŗĢåŹĒ³Źš¤½ŗדµÄĪļÖŹ
B.½ŗĢåµÄĶā¹Ū²»ĶøĆ÷”¢²»¾łŌČ
C.ĄūÓĆ°ėĶøĤæÉŅŌ³żČ„AgI½ŗĢåÖŠµÄKNO3
D.ĄūÓĆĀĖÖ½æÉŅŌ¹żĀĖ³żČ„µ°°×ÖŹ½ŗĢåÖŠµÄŹ³ŃĪ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶Ę×÷ĪŖŅ»ÖÖŠĀŠĖ²ÄĮĻČÕŅę±»ÖŲŹÓ£¬ÓŠ”°³¬¼¶½šŹō”¼ā¶Ė½šŹō”æռ佚Źō”±Ö®³Ę”£¹¤ŅµÉĻ³£ÓĆĀĢÖłŹÆ£ØÖ÷ŅŖ³É·Ö3BeO£®Al2O3”¤6SiO2£¬»¹ŗ¬ÓŠĢśµČŌÓÖŹ£©Ņ±Į¶īė£¬Ņ»ÖÖ¼ņ»ÆµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
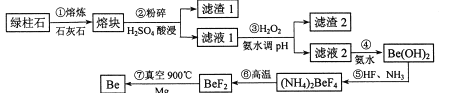
°“ŌŖĖŲÖÜĘŚ±ķµÄ¶Ō½ĒĻß¹ęŌņ£¬BeŗĶAlŠŌÖŹĻąĖĘ£»¼øÖÖ½šŹōŃōĄė×ÓµÄĒāŃõ»ÆĪļ³ĮµķŹ±µÄpHČē±ķ”£»Ų“šĻĀĮŠĪŹĢā£ŗ

(1)²½Öč¢ŚÖŠ½«ČŪæé·ŪĖéµÄÄæµÄŹĒ_____________£»ĀĖŌü1µÄÖ÷ŅŖ³É·ÖŹĒ________”£
(2)²½Öč¢Ū¼ÓČėH2O2Ź±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________£¬“ÓĀĖŅŗ1ÖŠµĆµ½³ĮµķµÄŗĻĄķpHĪŖ__________£ØĢīŠņŗÅ£©”£
A 3.3-3.7 8 3.7”Ŗ5.0 C 5.0”«5.2 D.5.2”Ŗ6.5
(3)²½Öč¢Ü²»ŅĖŹ¹ÓĆNaOHČÜŅŗĄ“³ĮµķBe2+µÄŌŅņŹĒ_____________”£“ÓČÜŅŗÖŠµĆµ½(NH4)2BeF4µÄŹµŃé²Ł×÷ŹĒ_______”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ”£
(4)²½Öč¢ŽµÄ·“Ó¦ĄąŠĶŹĒ_______£¬²½Öč¢ßŠčŅŖøō¾ųæÕĘųµÄ»·¾³£¬ĘäŌŅņŹĒ_____________”£
(5)ČōĀĢÖłŹÆÖŠBe0µÄŗ¬ĮæĪŖa%£¬ÉĻŹö¹ż³ĢÉś²śBeµÄ²śĀŹĪŖb%£¬Ōņ1tøĆĀĢÖłŹÆĄķĀŪÉĻÄÜÉś²śŗ¬īėĮæ2%µÄ¶ĘĶŗĻ½š_______t”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com