
在常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是 ( )。
A.0.1 mol·L-1 pH=7.82 的 NH4HCO3 溶液中: c(HCO3-)>c(NH4+)>c(OH-)>c(H+)
B.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
C.浓度均为 0.1 mol·L-1的NH3·H2O 溶液和 NH4Cl 溶液等体积混合:c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-)
D.0.1 mol·L-1 Na2S 溶液与 0.1 mol·L-1 NaHS 溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:实验题
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S 2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
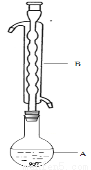
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
一定条件下反应N2(g)+3H2(g)  2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
下图表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子)。
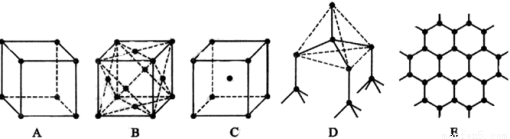
(1)其中代表金刚石的是 (填编号字母,下同),金刚石 中每个碳原子与 个碳原子最接近且距离相等。
中每个碳原子与 个碳原子最接近且距离相等。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为____ 个;
(3)其中表示氯化钠的是 ,每个钠离子周围与它最接近且距离相等的钠离子有 个;
(4)代表氯化铯的是 ,每个铯离子与 个氯 离子紧邻;
离子紧邻;
(5)代表干冰的是 ,每个二氧化碳分子与 个二氧化碳分子紧邻;
(6)由Mg、C、Ni三种元素形成的一种具有超导性的晶体,晶胞如图2所示。Mg位于C 和Ni原子紧密堆积所形成的空隙当中。与一个Ni原子距离最近的Ni原子的数目为 ,该晶体的化学式为 。


(图2) (图3)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨烯(单层石墨)中含有C-C键的数目为3NA
C.60gSiO2中含Si—O键的个数为2NA
D. 六方最密堆积的配位数是12,空间利用率是74%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g) 3Z(g)平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是( )
3Z(g)平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为 1∶1 D.第二次平衡时,Z的浓度为 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶滚为KOH溶液,反应为2Zn+O2+ 4OH-+2H2O=2Zn(OH)42-。下列说法正确的是( )
A.放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42-
B.充电时,电解质溶液中K+向阳极移动
C. 充电时,电解质溶液中c(OH-)逐渐减小
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:填空题
盐酸、硫酸和硝酸是常见的“三大酸”。现就三大酸与金属铜反应的情况,回答问题:
(1)稀盐酸不与Cu 反应,若在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为:____________________________。
(2)在一定体积的10mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积__________(填“大于”、“ 等于”或“小于”)180mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_____________________。
(3)镁铁混合物4.8g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2 .24LNO气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是_________克。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:选择题
室温下,甲溶液中由水电离出的H+浓度为10-12mol/L,乙溶液中由水电离出的H+浓度为10-2mol/L。下列说法中正确的是( )
A.甲、乙两溶液的pH不可能相同
B.甲、乙两溶液中分别加入A1粉都会产生H2
C.HCO3-不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液.乙不可能是酸或碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com