
| A. | KOH是氧化剂 | B. | Cl2发生还原反应 | ||
| C. | KFeO4是氧化产物 | D. | 生成lmol K2Fe04转移6mol的电子 |
分析 2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;一定条件\;}}{\;}$2K2FeO4+6KCl+8H2O反应中,Cl元素的化合价降低,Fe元素的化合价升高,结合氧化还原反应的概念分析.
解答 解:A、Cl元素的化合价降低,Cl2为氧化剂,Fe元素的化合价升高,Fe(OH)3为还原剂,则KOH不是氧化剂,故A错误;
B、反应中Cl元素的化合价降低,Cl2为氧化剂,则Cl2发生还原反应,故B正确;
C、Fe元素的化合价升高,Fe(OH)3为还原剂,生成K2FeO4是氧化产物,故C正确;
D、根据反应生成1 mol K2FeO4,消耗1molFe(OH)3,化合价由+3价升高到+6价,转移电子3mol,故D错误.
故选BC.
点评 本题考查氧化还原反应,题目难度不大,把握反应中元素化合价的变化以及从化合价变化的角度分析氧化还原反应.


科目:高中化学 来源: 题型:多选题
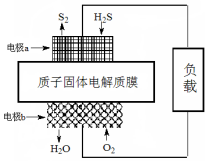 已知:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为H2S燃料电池的示意图.下列说法正确的是( )
已知:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电路中每通过4 mol电子,电池内部释放632 kJ热能 | |
| D. | 每34 g H2S参与反应,有2 mol H+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2$\stackrel{H_{2}O}{→}$H2CO3$\stackrel{BaCl_{2}(aq)}{→}$BaCO3 | B. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | ||
| C. | MgCO3$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{通电}{→}$Mg | D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$FeCl2(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
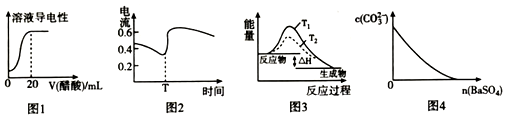
| A. | 图1表示向20mL0.lmol•L-l氯水中逐滴加入0.lmol•L-1醋酸,溶液导电性随加入酸体积的变化 | |
| B. | 图2表示酸性介质Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了 H2O2 | |
| C. | 图3表示S02与O2反应过程中的能量变化,其中T1>T2 | |
| D. | 图4表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c( CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除去杂质使用的试剂 | 除去杂质的方法 |
| A | CO2气体(HC1气) | 饱和Na2CO3溶液,浓硫酸 | 洗气 |
| B | NH4Cl固体(I2) | 加热 | |
| C | FeCl2溶液(FeCl3) | 氯水 | |
| D | MgCl2溶液(A1C13) | NaOH溶液,稀盐酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N的正反应速率是M的逆反应速率的3倍 | |
| B. | 恒温恒容下,通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 恒温下,扩大容器体积至原来的两倍,则N物质的量浓度大于0.6 mol/L | |
| D. | 恒温恒压下,增加Z的物质的量,重新达平衡时,N物质的量浓度大于0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
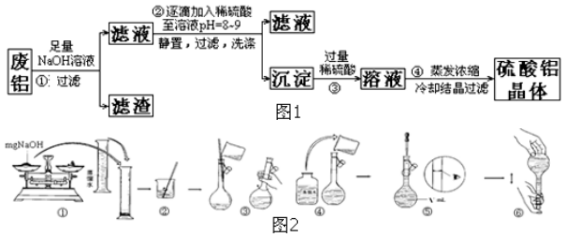
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com