
| 1 |
| 2 |
| 1 |
| 2 |
| v |
| vm |
| 1.792L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
|
|


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、FeCl3溶液能使KI淀粉试纸变蓝 |
| B、FeCl3溶液滴入沸水中产生红褐色的胶体 |
| C、FeCl3溶液中加入AgNO3溶液产生白色沉淀 |
| D、FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
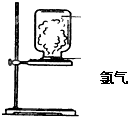 如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
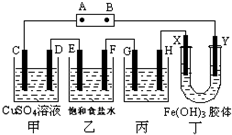 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com