
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。
【答案】 c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 5 减小 2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-
【解析】(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液是草酸氢钾,溶液呈酸性,说明草酸氢根的电离程度大于水解程度,因此该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。(2)醋酸的电离平衡常数大于次氯酸,酸性是醋酸大于次氯酸,酸越弱,酸根越容易水解,则pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK>NaClO;溶液中c(Na+)-c(ClO-)=c(OH-)-c(H+), c(K+)-c(CH3COO-)=c(OH-)-c(H+),由于pH相等,则两溶液中[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)]。(3)根据醋酸的电离平衡常数可知溶液中c(H+)=Kac(CH3COOH)/ c(CH3COO-)=10-5mol/L,则此时溶液pH=5。(4)根据醋酸的电离平衡常数可知溶液中![]() =Ka/c(CH3COO-),温度不变平衡常数不变,加热醋酸钠固体后溶液醋酸根浓度增大,则比值减小;(5)根据电离平衡常数可知碳酸的酸性强于次氯酸,次氯酸的酸性强于碳酸氢根,则向碳酸钠溶液中滴加少量氯水的离子方程式为2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-。
=Ka/c(CH3COO-),温度不变平衡常数不变,加热醋酸钠固体后溶液醋酸根浓度增大,则比值减小;(5)根据电离平衡常数可知碳酸的酸性强于次氯酸,次氯酸的酸性强于碳酸氢根,则向碳酸钠溶液中滴加少量氯水的离子方程式为2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离子键,又含有共价键的物质是_______,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程: __________。
(3)氮化钠(Na3N)是科学家制备的种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:①CH4 ②CH2=CH2 ③CH3CH2CH2CH3 ④CH3CH2OH ⑤ CH3COOH
(1)与①互为同系物的是______(填序号)。
(2)写出④的官能团名称______。
(3)写出③的同分异构体的结构简式______。
(4)写出②发生加聚反应生成聚乙烯的化学方程式______。
(5)④与⑤发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M,R,X,Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
(1)R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .
(3)X与M形成的XM3分子的空间构型是 .
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号). 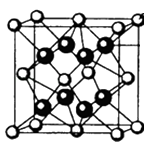
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。

(1)图中属于烷烃的是_________;属于烯烃的是_______(填字母)。
(2)上图中互为同分异构体的是A与____; B与______;D与____(填字母)。
(3)C的化学式为____________;其一氯代物的同分异构体有___种。
(4)写出B与氯化氢反应的化学反应方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,b和c为两种常见的金属元素,a、b、c、d的最高价氧化物对应的水化物依次为甲、乙、丙、丁,它们之间存在如图所示的反应关系(图中用“--“相连的两种物质间能发生反应)。下列判断一定正确的是
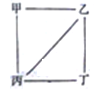
A. 简单离子半径:d>b>c>a
B. 等物质的量的ba3、b3a所含离子总数不相等
C. d的最高化合价和最低化合价的代数和为6
D. b和d组成的化合物的水溶液是中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol任何物质都含有约6.02×1023个原子
B.常温下,22.4LSO2所含的分子数为NA
C.摩尔是物质的量的单位
D.H2O 的摩尔质量是18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com