
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 |
非金属性:Br>I |
| A、A | B、B | C、C | D、D |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
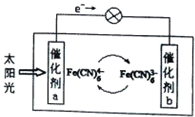 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液褪色,加热又变红 | 气体为SO2 |
| C | 将气体通过饱和Na2CO3溶液 | 除去CO2中的HCl |
| D | 配制FeSO4溶液时,应加入过量铁粉和稀硫酸 | 溶液中不断产生FeSO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 |
| B、石油和植物油都是混合物,且属于不同类的有机物 |
| C、乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应 |
| D、纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
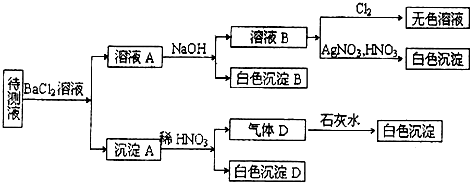
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 4 |
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加入足量BaCl2溶液,反应后进行、干燥、称量,再向沉淀中加足量稀盐酸、然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数2.33g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com