
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1 mol乙醇中含有极性键的数目为8NA | |
| C. | 1mol的-NH2与1molNH4+所含电子数均为10NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
分析 A、求出18gH218O的物质的量,然后根据H218O中含10个质子来分析;
B、乙醇中含7条极性键;
C、-NH2与NH4+所含的电子数分别为9个和10个;
D、氧化钠和过氧化钠均含2个钠离子和1个阴离子.
解答 解:A、18gH218O的物质的量为0.9mol,而H218O中含10个质子,故0.9mol中含9NA个质子,故A错误;
B、乙醇中含7条极性键,故1mol乙醇中含7NA条极性键,故B错误;
C、-NH2与NH4+所含的电子数分别为9个和10个,故1mol的-NH2与1molNH4+所含的电子数分别为9NA和10NA个,故C错误;
D、氧化钠和过氧化钠均含2个钠离子和1个阴离子,故1mol两者的混合物中含有的阴阳离子共3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入Ca(ClO)2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | CO2通入BaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):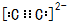 ,基态R原子的价电子排布式为2s22p4.
,基态R原子的价电子排布式为2s22p4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合后溶液pH=7,则c(M+)=c(Cl-) | |
| B. | 若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) | |
| C. | 若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com