


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、1L 0.2 mol/L A1C13溶液 |
| B、100ml 0.3 mol/L MgCl2溶液 |
| C、0.5L 0.1 mol/L NaCl溶液 |
| D、1L 0.3 mol/L HC1溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:


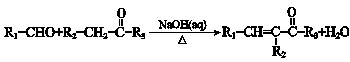 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |
| B、减少压强,逆反应速率增大,正反应速率减少,平衡向逆方向移动 |
| C、移去部分SO3,正反应速率增大,逆反应速率减少,平衡向正方向移动 |
| D、加入催化剂,正、逆反应速率都增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(H2S)通过CuSO4溶液洗涤? |
| B、SO2(SO3)通过饱和NaHSO3溶液洗涤? |
| C、Na2SO3溶液(Na2SO4)滴加适量的BaCl2溶液? |
| D、Na2SO4溶液(Na2SO3)滴加适量的H2SO4溶液? |
查看答案和解析>>
科目:高中化学 来源: 题型:
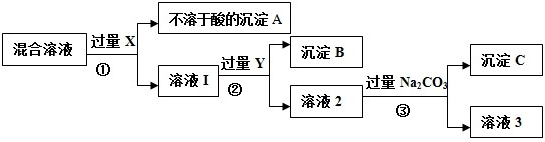
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,物质的量之比n(A):n(B):n(C)=2:11:4 |
| B、x值等于3 |
| C、A的转化率为20% |
| D、B的平均反应速率为0.4 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com