
| 1.02g |
| 102g/mol |
| 11.65g |
| 233g/mol |
| n |
| V |
| 0.05mol |
| 0.1L |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B、在H2O2分解过程中,溶液的H+浓度逐渐下降 |
| C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| D、H2O2生产过程中往往需要加入少量Fe2+以提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲装置:可用来证明碳酸的酸性比硅酸强 |
| B、乙装置:c为二氧化硅可制硅酸 |
| C、丙装置:可进行氢氟酸与二氧化硅的反应并测定气体体积 |
| D、丁装置:从②口进气可用于收集二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

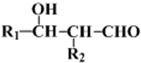
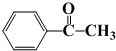 )的合成路线(不超过四步)(合成路线常用的表示方式为:A
)的合成路线(不超过四步)(合成路线常用的表示方式为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCOO-)>c(Na+) |
| B、c(HCOO-)<c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、无法确定c(HCOO-)与c(Na+)的关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com