
| A. | 25℃,将pH=4的盐酸和醋酸分别加水稀释成pH=5,所加水的量 | |
| B. | 25℃,pH=10的NaOH溶液和Na2CO3溶液中,由水电离出的c(OH-) | |
| C. | 25℃,物质的量浓度相等的 (NH4)2SO4和 (NH4)2CO3溶液中的c(NH4+) | |
| D. | 25℃,Na2CO3溶液中HCO3-和OH-的数目 |
分析 A.加水稀释,醋酸进一步电离;
B.NaOH抑制水的电离,Na2CO3促进水的电离;
C.(NH4)2CO3为弱酸弱碱盐,NH4+与CO32-离子发生相互促进的水解;
D、Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-和水的电离平衡.
解答 解:A.醋酸为弱酸,加水促进电离,当将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,醋酸加水多,故A错误;
B.NaOH抑制水的电离,Na2CO3溶液中CO32-离子水解促进水的电离,pH=10的NaOH和Na2CO3溶液,Na2CO3溶液中水的电离程度较大,故B错误;
C.(NH4)2CO3为弱酸弱碱盐,NH4+与CO32-离子发生相互促进的水解,物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH4+的物质的量浓度前者较大,故C正确;
D、Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-和水的电离平衡,所以HCO3--的数目小于OH,故D错误;
故选C.
点评 本题考查较为综合,涉及弱酸的电离,盐类的水解,题目难度不大,注意相关基础知识的积累,注意影响盐类水解的因素.


科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由0.1mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| B. | 由10mLpH=3的CH3COOH溶液与1 mL pH=11的NaOH溶液混合而成 | |
| C. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| D. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收电池中的石墨电极 | |
| B. | 回收电池外壳金属材料 | |
| C. | 防止电池中汞、镉、铜等重金属对土壤和水源的污染 | |
| D. | 防止电池中的渗出液腐蚀其它物品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO2跟48gO3 含有的氧原子数均为3NA | |
| B. | 1L 0.5mol/L的(NH4)2SO4溶液中含有NH4+数目为NA | |
| C. | 标准状况下,11.2L 氨气所含有的原子数是4NA | |
| D. | 80gNaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 干冰升华时,分子内共价键会发生断裂 | |
| C. | 由原子构成的晶体可以是原子晶体,也可以是分子晶体 | |
| D. | 只要含有金属阳离子的晶体就一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
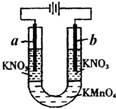 如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.
如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com