
 ;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
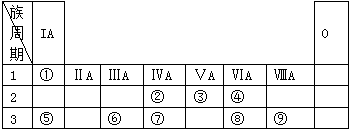
;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.分析 由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl.
(1)最高价含氧酸的酸性强弱等可以说明元素非金属性强弱;碳和浓硫酸在加热条件下反应生成二氧化碳、二氧化硫与水;
(2)Z、W由H、N、O中的两种或三种元素组成.Z的浓溶液常温下能使铁钝化,则Z为硝酸;W中H、N两种元素的质量比为3:14,则H、N原子数目之比=$\frac{3}{1}$:$\frac{14}{14}$=3:1,故W为NH3;氨气与氧气反应生成NO与水;
(3)通常用NaOH作电解质,用Al单质、石墨作电极,在石墨电极一侧通入空气,反应本质是Al与氢氧化钠反应,负极是Al失去电子,碱性条件下生成偏铝酸与水;
⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,则为SO2,用某种燃料电池,通常用硫酸溶液作电解质,用石墨作电极,在一端通入空气,另一端通入SO2,该原电池本质是二氧化硫与氧气、水反应生成硫酸,该电池负极是二氧化硫失去生成生成硫酸根,由电荷守恒可知还生成氢离子
解答 解:由元素在周期表中位置,知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl.
(1)酸性HClO4>H2SO4可以说明元素非金属性Cl>S;碳和浓硫酸在加热条件下反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:酸性HClO4>H2SO4;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)Z、W由H、N、O中的两种或三种元素组成.Z的浓溶液常温下能使铁钝化,则Z为硝酸,化学式为HNO3;W中H、N两种元素的质量比为3:14,则H、N原子数目之比=$\frac{3}{1}$:$\frac{14}{14}$=3:1,故W为NH3,其电子式为: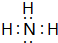 ,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:HNO3;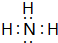 ;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)通常用NaOH作电解质,用Al单质、石墨作电极,在石墨电极一侧通入空气,反应本质是Al与氢氧化钠反应,负极是Al失去电子,碱性条件下生成偏铝酸与水,负极电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;
⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,则为SO2,用某种燃料电池,通常用硫酸溶液作电解质,用石墨作电极,在一端通入空气,另一端通入SO2,该原电池本质是二氧化硫与氧气、水反应生成硫酸,该燃料电池产物为硫酸,该电池负极是二氧化硫失去生成生成硫酸根,由电荷守恒可知还生成氢离子,负极电极反应式为:SO2-2e-+2H2O=SO42-+4H+,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;SO2-2e-+2H2O=SO42-+4H+;H2SO4 .
点评 本题考查元素周期表与元素周期律、元素化合物推断、燃料电池等,(3)为易错点、难点,明确原电池反应本质是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上以氯气和饱和石灰水为原料制造漂白粉 | |
| B. | 工业上常用氢气在氯气中燃烧生成氯化氢,然后将其溶于水的方法生产盐酸 | |
| C. | 以电解饱和食盐水为基础获取氯气等产品的工业称为“氯碱工业” | |
| D. | 干冰和碘化银可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石不是化学变化 | |
| B. | 石墨比金刚石稳定 | |
| C. | 1mol石墨具有的总能量比1mol金刚石的高 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,不法厂商将这种本是用于塑料生产的物质添加到饮料、食品中,从而造成了人类史上最大的塑化剂污染事件,下面有关该物质的说法中错误的是( )
,不法厂商将这种本是用于塑料生产的物质添加到饮料、食品中,从而造成了人类史上最大的塑化剂污染事件,下面有关该物质的说法中错误的是( )| A. | 分子式为C24H38O4 | |
| B. | 在NaOH溶液中水解会生成邻苯二甲酸与2-乙基-1-己醇 | |
| C. | 该物质进入人体内会有害身体健康 | |
| D. | 难溶于水,可溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
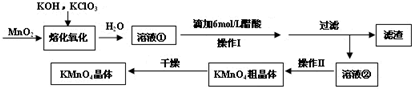
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
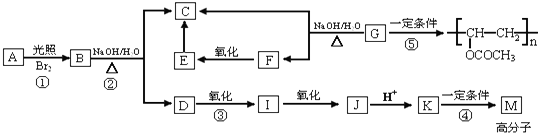
 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$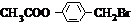 +HBr,反应③:
+HBr,反应③: .
.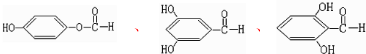 任意一种即可.
任意一种即可.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
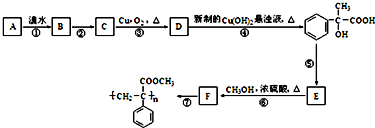
 .
.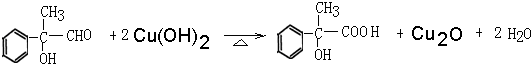 .
.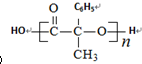 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已达平衡状态 | B. | 未达平衡状态,反应正向进行 | ||
| C. | 未达平衡状态,反应逆向进行 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该金刚石粉末与水混和后能产生丁达尔现象 | |
| B. | 该反应属于置换反应 | |
| C. | CCl4和CH4在常温下均为无色气体 | |
| D. | 金刚石属于非金属单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com