
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
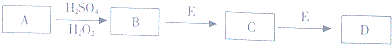
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )| A. | 反应温度T1>T2该反应是吸热反应 | |
| B. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| C. | M点的平衡常数比W点的平衡常数小 | |
| D. | M点时再加入一定量的X,平衡后X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
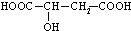 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸能使紫色的石蕊试液变红 | |
| B. | 苹果酸能发生酯化反应 | |
| C. |  与苹果酸是同一种物质 与苹果酸是同一种物质 | |
| D. | 1mol苹果酸在一定条件下可与2molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
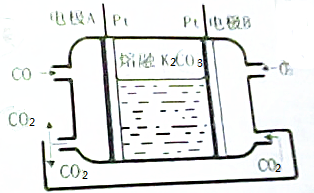
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
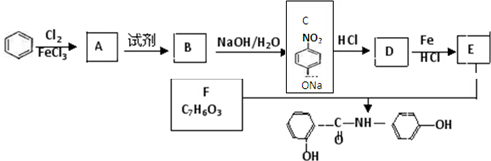
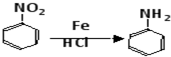
 .
. .
. 、
、 、
、 (任选两种)(写出各种结构).
(任选两种)(写出各种结构).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com