

金属 电子流动方向 电压/V
A A→Cu -0.78
B Cu→B -0.15
C C→Cu +1.35
D D→Cu +0.30
已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据记录数据判断,下列有关说法正确的是( )
A.在四种金属中C的还原性最强
B.金属B能从硫酸铜溶液中置换出铜
C.A、D若形成原电池时,A为正极
D.A、B形成合金时,将该合金露置在空气中,A先被腐蚀
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| D | D→Cu | +1.35 |
| E | E→Cu | +0.30 |
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 金属 | 电子流动方向 | 电压/V |
| A | A→Fe | +0.76 |
| B | Fe→b | -0.18 |
| C | C→Fe | +1.32 |
| D | D→Fe | +0.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
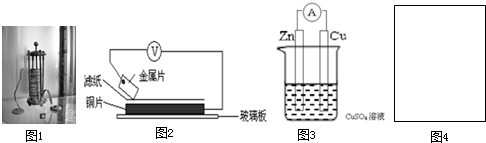
 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
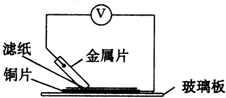
 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下: 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省四地六校高二第二次月考化学试卷 题型:填空题
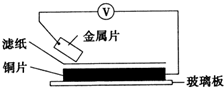
将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1) A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2) 若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(A、B、C、D中哪一种),此时对应的电极反应式为:正极___________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com