
 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
分析 由元素在周期表的位置可知,A为Na,B为K,C为Mg,D为Al,E为C,H为Si,R为N,F为O,I为S,G为Cl,
(1)R单质分子为氮气;
(2)金属性越强,对应高价氧化物的水化物的碱性越强;
(3)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
(4)X 的氢氧化物既能与氢氧化钠溶液反应,又能与盐酸反应,则X为Al,Al的最高价氧化物对应水化物为氢氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:由元素在周期表的位置可知,A为Na,B为K,C为Mg,D为Al,E为C,H为Si,R为N,F为O,I为S,G为Cl,
(1)R单质分子为氮气,结构式为N≡N,故答案为:N≡N;
(2)金属性Na>Mg>Al,A、C、D 三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH,故答案为:NaOH;
(3)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则A、B、C 三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)X 的氢氧化物既能与氢氧化钠溶液反应,又能与盐酸反应,则X为Al,Al的最高价氧化物对应水化物为氢氧化铝,与氢氧化钠溶液反应生成偏铝酸钠和水,离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意Al与强酸、强碱反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
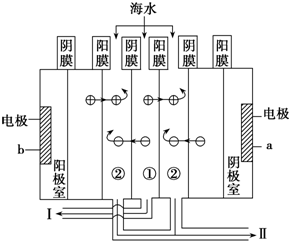
| 实验步骤 |
| 向硬水中加入①(填序数),直到不再产生沉淀为止. |
| 继续向溶液中加入③(填序数),直到不再产生沉淀为止. |
| 将上述混合物过滤(填操作) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
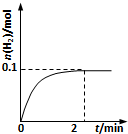 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
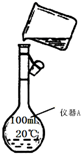 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向盛有1mL2%的硝酸银溶液中逐滴加入2%稀氨水,边滴边振荡至最初产生的沉淀恰好消失为止 | 配制少量银氨溶液 |
| B | 向盛有2mL10%的硫酸铜溶液的试管中滴加0.5mL10%氢氧化钠溶液,混合均匀,滴入待检液,加热 | 检验某溶液中是否含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液 | 检验淀粉是否水解完全 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合溶液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com