
| A. | 若所得溶液呈中性,则生成的盐可能为强酸强碱盐 | |
| B. | 若所得溶液呈碱性,则一定是强碱与弱酸溶液反应 | |
| C. | 若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 | |
| D. | 若所得溶液的pH=9,则水电离产生的c(OH-)可能为10-9mol/L |
分析 常温下pH=3的酸溶液和pH=11的碱溶液等体积混合,酸中c(H+)等于碱中c(OH-),
A.混合溶液呈中性,溶液中的溶质可能是强酸强碱形成的盐也可能是弱酸弱碱形成的盐,如果是弱酸、弱碱混合,弱酸和弱碱电离程度相同;
B.混合溶液呈碱性,可能是强酸和弱碱混合,弱碱浓度大于强酸,碱有剩余导致溶液呈碱性;也可能是弱酸、弱碱混合,且弱酸电离程度大于弱碱,混合溶液碱有剩余;
C.混合溶液呈酸性,可能是弱酸和强碱混合,弱酸浓度大于强碱,溶液呈酸性;也可能是弱酸和弱碱混合,弱酸浓度大于弱碱,弱酸有剩余;
D.若所得溶液的pH=9,溶液中c(H+)<10-7mol/L,抑制水电离,溶液中溶质含有酸和盐或碱和盐.
解答 解:常温下pH=3的酸溶液和pH=11的碱溶液等体积混合,酸中c(H+)等于碱中c(OH-),
A.混合溶液呈中性,溶液中的溶质可能是强酸强碱形成的盐也可能是弱酸弱碱形成的盐,如果是弱酸、弱碱混合,弱酸和弱碱电离程度相同,所以若所得溶液呈中性,则生成的盐可能为强酸强碱盐,故A正确;
B.混合溶液呈碱性,可能是强酸和弱碱混合,弱碱浓度大于强酸,碱有剩余导致溶液呈碱性;也可能是弱酸、弱碱混合,且弱酸电离程度大于弱碱,混合溶液碱有剩余,所以若所得溶液呈碱性,则可能是强碱与弱酸溶液反应也可能是弱酸、弱碱反应,故B错误;
C.混合溶液呈酸性,可能是弱酸和强碱混合,弱酸浓度大于强碱,溶液呈酸性;也可能是弱酸和弱碱混合,弱酸浓度大于弱碱,弱酸有剩余,所以若所得溶液呈酸性,可能是弱酸与强碱溶液反应,故C正确;
D.若所得溶液的pH=9,溶液中c(H+)<10-7mol/L,抑制水电离,溶液中溶质含有酸和盐或碱和盐,且酸或碱电离程度大于盐水解程度,所以水电离产生的c(OH-)可能为10-9mol/L,故D正确;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确混合溶液酸碱性与酸、碱强弱关系是解本题关键,可以采用逆向思维方法分析解答,易错选项是D.


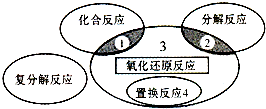
科目:高中化学 来源: 题型:选择题
| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | D. | Fe+CuSO4═Cu+FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(aq)═2NaHCO3(aq)△H=-(8x+2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
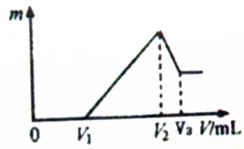 将0.1mol的镁、铝混合物溶于2mol/L H2SO4溶液中,然后再滴加0.1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于2mol/L H2SO4溶液中,然后再滴加0.1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 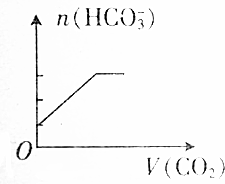 | B. | 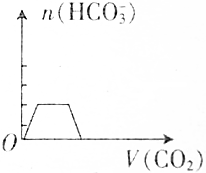 | ||
| C. | 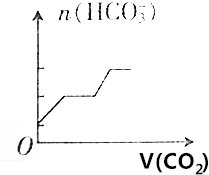 | D. | 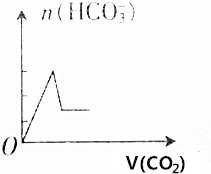 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液一定含有Fe2+ | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 108g | B. | 54g | C. | 216g | D. | 64g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com