
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
【答案】A
【解析】
A.硫酸酸化的KI淀粉溶液久置后变蓝,二者发生氧化还原反应,离子方程式为:4I-+O2+4H+=2I2+2H2O,故A正确;
B.铁和稀硝酸反应产物与量有关,铁少量时变成三价铁,溶液由无色变为黄色,离子方程式为Fe + 4H+ + NO3-=Fe3+ + NO↑+ 2H2O;铁过量时变成二价亚铁,溶液由无色变为浅绿色,离子方程式为:3Fe + 8H+ + 2NO3-= 3Fe2+ +2 NO↑+ 4H2O,故B错误;
C.醋酸是弱酸,不能拆成离子,反应的离子方程式为:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O = CaSO3↓+2HClO,生成的次氯酸具有强氧化性,能氧化亚硫酸钙,故D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
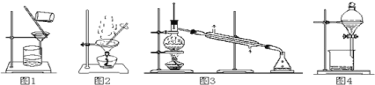
①用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
②用图2所示装置从氯化钠溶液中得到氯化钠晶体
③用图3所示装置从碘的四氯化碳溶液中分离出四氯化碳
④用图4所示装置从乙醇与苯的混合物中分离出苯
A.①②B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物H的合成路线如下:

已知:i. 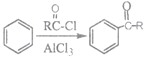
ii. 
回答下列问题
(1)A的化学名称为___________。
(2)B→C的化学方程式为______________________。
(3)E的结构简式为___________;由E生成F的反应类型为______________________。
(4)G中官能团名称为___________;由G→H的化学方程式为______________________。
(5)芳香族化合物L与G的官能团相同,但L的相对分子质量比G小28。则符合下列条件的L的同分异构体有___________种。
①与FeCl3溶液发生显色反应 ②苯环上有3个取代基
(6)按 有机合成路线可以制备
有机合成路线可以制备 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①写出CO2的电子式__________。
②用饱和Na2CO3溶液做吸收剂可“捕集”CO2。若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式___________。
③聚合离子液体是目前广泛研究的CO2 吸附剂。结合下图分析聚合离子液体吸附CO2的有利条件是__________。

(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H =-159.5 kJ/mol
H2NCOONH4(s) △H =-159.5 kJ/mol
第二步:H2NCOONH4(s)![]() CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
①写出上述合成尿素的热化学方程式_________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到________min时到达平衡。
(3)合成乙酸:
①中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:

原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O4(无色)![]() 2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )
2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )

A. CaO溶于水时吸收热量 B. 该反应的ΔH>0
C. NH4Cl溶于水时放出热量 D. 烧瓶(III)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Ag和Au(金)等。湿法处理阳极泥的一种工艺流程如下:

(1)在粗铜精炼过程中,粗铜与电源的__________极(填正、负)连接;阴极的电极反应式为______________________________________________________。
(2)在浸铜过程中,浸铜反应的离子方程式为_______________________________________________________,
生产中实际需要H2O2的量要远远超过浸铜所需的理论用量,可能的原因是________________________________________________。
(3)已知:浸金时,Au转化为AuCl4-。在理论上,提取金的过程中反应消耗NaClO3和H2C2O4的物质的量之比为__________。
(4)已知: 浸银时发生反应AgCl+2SO32-![]() Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
①为减少废液排放,充分利用资源,向浸银残液中通入气体X得到Na2SO3再生液,X是__________。
②在提取银过程中,其他条件不变,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示。

试结合平衡移动原理,解释产生这种变化的原因_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
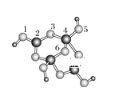
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.NaOH电离方程式:NaOH=Na++H++O2-
B.硫酸铝的电离方程式:Al2(SO4)3=Al23++(SO4)32-
C.NaCl的电离方程式:NaCl![]() Na++Cl-
Na++Cl-
D.硫酸氢铵电离方程式:NH4HSO4 =NH4++H++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com