
| 待测液 | 消耗标准盐酸(0.01mol?L-1)的体积 | |
| ① | 20mL NaOH溶液 | V1 mL |
| ② | 20mL NaOH溶液+10mL H2O | V2 mL |
| ③ | 敞开隔夜放置的20mL NaOH溶液 | V3 mL |
| A、c=0.01×(V1+V2+V3)/(3×20) |
| B、c=0.01×(V1+V2)/(2×20) |
| C、c=0.01×(V1+V3)/(2×20) |
| D、c=0.01×V1/20 |
| V2+V2 |
| 2 |
| V2+V2 |
| 2 |
| 0.01×(V1+V2) |
| 2×20 |


科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44.8 g固体物质为Na2CO3 |
| B、44.8 g固体物质为NaOH和Na2O2混合物 |
| C、44.8 g固体物质为0.2 mol NaOH和0.4 mol Na2CO3混合物 |
| D、44.8 g固体物质为0.2 mol NaOH、0.2 mol Na2CO3、0.2 mol Na2O2混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
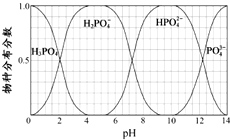 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取3.23gNaCl固体 |
| B、用50mL量筒量取30.12mL水 |
| C、用酒精萃取碘水中的碘 |
| D、用淘洗的方法从沙里淘金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:R>T>Y>Z |
| B、电负性:W<R<T |
| C、最高价氧化物对应的水化物碱性:X<Z |
| D、XR2、WR2两化合物中R的化合价相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com