
| 3mol-1.8mol |
| 2L?1min |
| 0.4mol/L |
| 1min |
| 2x |
| 1.5-3x+0.5-x+2x |
| c2(C) |
| c3(A)?c(B) |
| 0.62 |
| 0.63×0.2 |
| 3mol-1.8mol |
| 2L?1min |
| 0.4mol/L |
| 1min |
| 2x |
| 1.5-3x+0.5-x+2x |
| 0.5 |
| 1.5 |
| c2(C) |
| c3(A)?c(B) |
| 0.62 |
| 0.63×0.2 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、滴定过程中,初读数平视,末读数俯视 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、全部 |
| C、①③④⑤ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.2 mol/L A1C13溶液 |
| B、100ml 0.3 mol/L MgCl2溶液 |
| C、0.5L 0.1 mol/L NaCl溶液 |
| D、1L 0.3 mol/L HC1溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
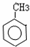
| CO、HCl |
| AlCl3/△ |
| M |
| OH- |
| -HO2 |
| △ |
C (C10H10O) |
| ①Cu(OH)2/△ |
| ②酸化 |
| CH3OH |
| 浓H2SO4/△ |
| 催化剂 |
F (高聚物) |

| AlCl3,HCl |
| △ |
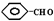
| OH- |
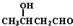
| -H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
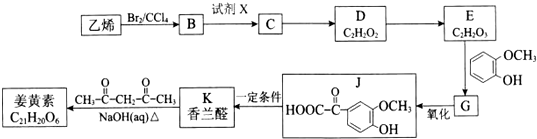

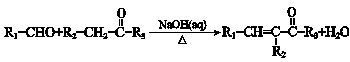 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com