
 .
. 、
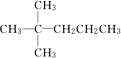
、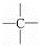 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如: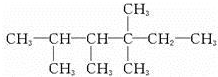
分析 (1)根据已知有机物的结构简式可判断,可以通过让两个甲基按照由心到边移动,即可得到同分异构体的结构简式;其中有一种同分异构体的分子,其一氯代物有4种同分异构体,也就是分子结构中有四种氢;
(2)①根据烷烃通式确定C原子与H原子之间的数量关系;或根据伯、仲、叔、季碳原子上含有H原子数目确定;
②由①中的关系式确定;
③根据②中关系式求出碳原子总数,写出分子式,写出符号条件的可能的同分异构体;
(3)根据电离出氢离子浓度的难以判断,烷烃的沸点随碳原子数的增多而升高,碳数相同时,支链越多,沸点越低.
解答 解:(1)根据已知有机物的结构简式可判断,可以通过让两个甲基按照由心到边移动,即可得到同分异构体的结构简式,所以共计是4种、分别是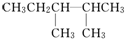 、
、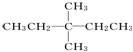 、
、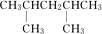 、
、 ,其一氯代物有4种同分异构体的是
,其一氯代物有4种同分异构体的是 ,
,
故答案为:4; ;
;
(2)①由于烷烃的通式为CnH2n+2,C原子与H原子之间的数量关系为N0=2(N1+N2+N3+N4)+2,伯、仲、叔、季碳原子上含有的H原子数目分别为3、2、1、0,所以C原子与H原子之间的数量关系为N0=3N1+2N2+N3,
故答案为:3N1+2N2+N3;
②由①中可得,2(N1+N2+N3+N4)+2=3N1+2N2+N3,故N3+2N4+2=N1,
故答案为:N3+2N4+2;
③由②中N3+2N4+2,当N2=N3=N4=1时,N1=5,碳原子总数为8,则该烷烃的分子式为C8H18,满足N2=N3=N4=1的结构可能有3种:(CH3)3CCH(CH3)CH2CH3 、(CH3)3CCH2CH(CH3)2、(CH3)2CHC(CH3)2CH2CH3,
故答案为:CH3CH2C(CH3)2CH(CH3)2;
(3)因电离氢离子难易程度③>①>②,与易电离出氢离子,则越易与钠反应,则反应剧烈程度③>①>②,烷烃的沸点随碳原子数的增多而升高,所以乙烷、丙烷、丁烷、戊烷依次沸点变高;碳原子数相同时支链越多,沸点越小,所以戊烷沸点高于异丁烷,顺序为⑤④①③②,
故答案为:③>①>②;⑤④①③②.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构以及同分异构体的判断,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
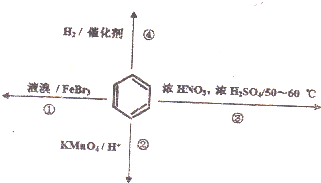
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应,产物是无色液体 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
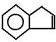 ,易发生加成、加聚等反应.茚有一种同分异构体A,A分子中的碳原子不完全在同一平面上,且A分子中含有一个苯环,A有如下转化关系:
,易发生加成、加聚等反应.茚有一种同分异构体A,A分子中的碳原子不完全在同一平面上,且A分子中含有一个苯环,A有如下转化关系: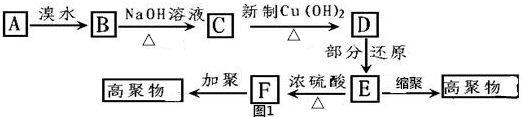
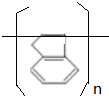 .
.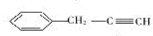 ,B是
,B是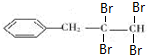 (均填结构简式).
(均填结构简式).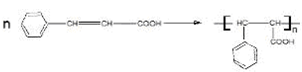 .
.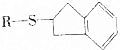 的反应类型是加成反应.
的反应类型是加成反应.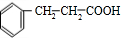 、
、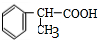 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
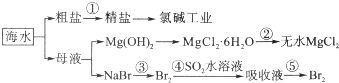
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
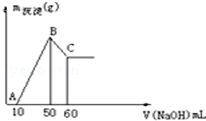 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
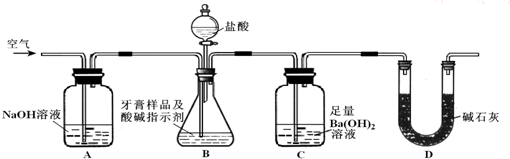
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,用湿润的红色石蕊试纸在试管口观察现象 | |
| B. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| C. | 加强碱溶液,加热,滴入酚酞试液,观察溶液颜色 | |
| D. | 加苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口进行检验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com