
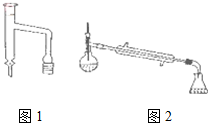
 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: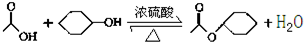
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
分析 (1)根据装置中仪器的使用方法判断;
(2)酯化反应是可逆反应,增加一种反应物的物质的量可以提高另一种反应物的转化率;
(3)减少生成的物质的量可以提高反应物的转化率;
(4)反应液中有硫酸、醋酸等酸性物质,可以与碳酸氢钠反应,再用水除去碳酸氢钠;无水MgSO4的具有吸水性;
(5)根据产率=$\frac{实际产量}{理论产量}$×100%进行计算;
(6)环己醇的沸点比乙酸环己酯低,若采用如图3装置,产品中有未反应的环己醇.
解答 解:(1)冷凝管使用时,冷凝水应从下口进上口出,
故答案为:冷凝水应从下口进上口出;
(2)酯化反应是可逆反应,增加一种反应物的物质的量可以提高另一种反应物的转化率,所以增加乙酸的量可以提高环已醇的转化率,
故答案为:提高环已醇的转化率;
(3)在制乙酸环己酯的反应中,水是生成物,将生成的水及时从体系中分离出来,提高反应物的转化率,
故答案为:将生成的水及时从体系中分离出来,提高反应物的转化率;
(4)反应混合液中有硫酸、醋酸等酸性物质,可以与碳酸氢钠反应,所以可以用再用碳酸氢钠洗去硫酸和醋酸,再用水可以洗去碳酸氢钠,无水MgSO4的具有吸水性,所以用,无水MgSO4干燥产品,
故答案为:洗去硫酸和醋酸;洗去碳酸氢钠;干燥;
(5)0.2mol乙酸和0.1mol环己醇反应,理论上可以生成0.1mol乙酸环己酯,即14.2g,而实际产量是6.9g,所以本次实验的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{6.9g}{14.2g}$×100%=48.6%,
故答案为:48.6%;
(6)环己醇的沸点比乙酸环己酯低,若采用如图3装置,产品中有未反应的环己醇,所以会使实验的产率偏高,
故答案为:偏高;产品中会收集到未反应的环己醇.
点评 本题考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
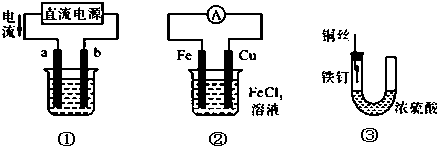
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 | |
| D. | 容量瓶不能长期存放配制好的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com