
取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份。其中一份通入足量的氢气充分反应后固体质量为25.6 g,另一份加入到500 mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48 L。已知Cu2O+2H+===Cu+Cu2++H2O。则稀硝酸的浓度为( )
A.2 mol/L B.1.6 mol/L
C.0.8 mol/L D.0.4 mol/L
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
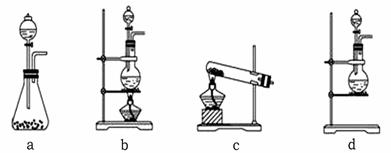
某校化学兴趣小组为制备消毒液(主要成分是NaClO)设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:
 3Cl2 + 6OH—5Cl— + ClO3— + 3H2O
3Cl2 + 6OH—5Cl— + ClO3— + 3H2O

请回答下列问题:
(1)连接好装置,装药品之前,必须进行的一项操作步骤是____________________。
(2)圆底烧瓶内发生反应的化学方程式为_____________________________________;大试管内发生反应的离子方程式为__________________________________________。
(3)饱和食盐水的作用是_________________________________;冰水的作用是______
___________________________。
(4)在制取Cl2时,实验室中若无MnO2,可用KMnO4粉末代替,发生下列反应:
2KMnO4 + 16HCl(浓)= 2MnCl2 + 2KCl + 5Cl2↑+ 8H2O
则可选择的发生装置是(填序号)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
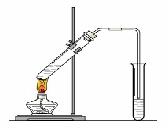 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
⑴写出制取乙酸乙酯的化学反应方程式
⑵浓硫酸的作用是:① ;②
⑶饱和碳酸钠溶液的主要作用是
⑷装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,
目的是防止 。
⑸若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数。下列叙述中正确的是( )
A.10 gH O中所含的中子数为4NA
O中所含的中子数为4NA
B.1 mol苯分子中含有的碳碳双键数为3NA
C.标准状况下,22.4 L Cl2完全反应,转移的电子数一定是2NA
D.常温常压下,100 mL 0.5 mol·L-1的乙酸溶液中,乙酸的分子数目小于0.05 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA
B.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
C.常温常压下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA
D.标准状况下,2.24 L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
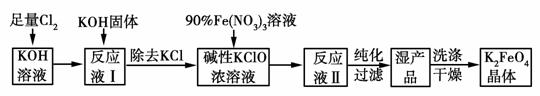
已知:2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是_________。
(2)写出工业上制取Cl2的化学方程式__________________。
(3)在“反应液Ⅰ”中加入KOH固体的目的是_________。
(4)K2FeO4可作为新型多功能水处理剂的原因是_____________。
(5)配制KOH溶液时,将61.6 g KOH固体完全溶解在100 mL水中,所得溶液的密度为1.47 g·mL-1,则该溶液的物质的量浓度为__________________。
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是________、________(写化学式)。
(7)该工艺每得到1.98 Kg K2FeO4,理论上消耗Cl2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列防止金属腐蚀的做法不可行的是
A.在某些工具的机械转动部位刷油漆
B.在钢铁中加入铬
C.在较小钢铁制品的表面包裹塑料
D.在大型铁壳船的船身上装上一定数量的锌块
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com