
| A. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| B. | 常温常压下,22.4 L CH4中含有的C-H键数为4NA | |
| C. | 含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA | |
| D. | lmol FeCl2与足量氯气反应时转移的电子数为2NA |
分析 A、乙烯与丙烯的最简式均为CH2,计算7gCH2中的氢原子数得到;
B、常温常压下,不能用气体摩尔体积公式计算CH4的物质的量;
C、浓硫酸随反应进行浓度变稀后不与铜反应;
D、Fe2+~Fe3+~e-,据此计算.
解答 解:A、7.0g乙烯与丙烯的混合物中含有氢原子的数目,因为乙烯与丙烯的最简式均为CH2,所以计算7gCH2中的氢原子数=$\frac{7g}{14g/mol}×2$mol=1mol=NA,故A正确;
B、常温常压下,22.4 L CH4的物质的量不是1mol,故B错误;
C、0.2mol浓硫酸与足量铜微热反应,浓硫酸随反应进行浓度变稀后不与铜反应,生成SO2分子的数目小于0.1NA,故C错误;
D、lmol FeCl2与足量氯气反应时转移的电子数为NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常的应用,主要考查气体摩尔体积的体积应用,质量换算物质的量计算微粒数,关键是浓硫酸岁反应进行浓度变稀不与铜反应,合成氨反应是可逆反应,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H、Be、B原子最外层电子数依次增多 | B. | P、S、Cl元素最高正化合价依次降低 | ||
| C. | C、N、O、F原子半径依次增大 | D. | Li、Na、K、Rb的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
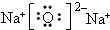 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
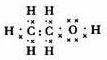 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 0.1 molCH2=CH-COOH中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和乙烯组成的56 g混合气体中氢原子的个数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、NO3-、H+ | B. | K+、Mg2+、I-、ClO- | ||
| C. | K+、Ba2+、Cl-、Br- | D. | K+、HCO3-、Cl-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com