
设N0为阿伏加德罗常数的值。下列叙述正确的是( )。
A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N0
B.12 g石墨烯(单层石墨)中含有六元环的个数为0.5N0
C.25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1N0
D.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N0
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:选择题
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是( )。

A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
短周期主族元素A、B、C、D、E的原子序数依次增大,A、B同周期,B、D同主族,D原子的核内质子数是B原子的2倍,A、E的原子序数之和与B、D的原子序数之和相等,C的单质与NaOH溶液或盐酸都能反应生成氢气。下列叙述正确的是 ( )。
A.元素A的最高价氧化物的水化物的酸性比E的强
B.元素B、C组成的化合物可用做耐高温材料
C.元素C、D、E的简单离子的半径依次减小
D.化合物AB2、DB2中化学键的类型相同
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是( )。
A.Na+、Ba2+、Cl-、NO3— B.Pb2+、Hg2+、S2-、SO42—
C.NH4+、H+、S2O32—、PO43— D.Ca2+、Al3+、Br-、CO32—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第2讲化学常用计量练习卷(解析版) 题型:选择题
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )。

A.硫酸溶液的体积为10 mL
B.b时刻溶液中SO42—的浓度约为0.125 mol·L-1
C.d时刻溶液的pH为13
D.溶液的导电能力:c<d<b<a
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:填空题
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下表各组归类
序号分类标准归类
AFeSO4、NO2、MnO2、NaClO、Cu3P、Na2O2H2SO3
BCH3COOH、HOOC—COOH、HClO、H2SHF
C复分解反应、电解反应、放热反应、离子反应焰色反应
D(NH4)2SO4、NH4Cl、NH4NO3、NH3·H2ONH4HCO3
(1)A中分类标准是_____________________,H2SO3________(填“是”或“否”)可归为此类。
(2)B中分类标准是_________________________,HF________(填“是”或“否”)可归为此类。
(3)C中分类标准是__________________,焰色反应属于________变化。
(4)D中分类标准是__________________,NH4HCO3________(填“是”或“否”)可归为此类。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:选择题
下列化学用语表示正确的是( )。
A.Cl-的结构示意图:
B.甲烷分子的球棍模型:
C.氢氧化钠的电子式: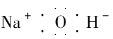
D.次氯酸的结构式:H—O—Cl
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是_________________________________________________
_______________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练专题12物质结构与性质(选修)练习卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com