
(12 分)(原创)部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
(1)请写出HNO2的电离方程式
(2)上表的5种酸进行比较,酸性最弱的是:_______________;HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是 。
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH—先后消耗的酸及酸式酸根依次是:_______________________。
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:_____________________________________________。
(5)下列离子方程式书写正确的是
A.HNO2 + HS— == NO2—+ H2S↑
B.2HCOOH+SO32— == 2HCOO—+H2O+SO2↑
C.H2SO3+2HCOO— == 2HCOOH+SO32—
D.H2SO3+ SO3 2— == 2HSO3—
(12 分,每空2分)
(1) HNO2  H+ + NO2— (2) H2S ;HSO3-。
H+ + NO2— (2) H2S ;HSO3-。
(3) H2C2O4、HCOOH、HC2O4- (4) 
(5) D
【解析】
试题分析:(1)HNO2为弱酸,则电离方程式为:HNO2  H+ + NO2—
H+ + NO2—
(2)电离常数越小,则弱酸的酸性越弱,所以上表的5种酸进行比较,酸性最弱的是:H2S ;酸性越强,酸根离子结合H+的能力越弱,所以HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是:HSO3-。
(3)根据电离常数的大小,可知酸性由强到弱的顺序为:H2C2O4、HCOOH、HC2O4-,所以被OH—先后消耗的酸及酸式酸根依次是:H2C2O4、HCOOH、HC2O4-。
(4)HNO2具有强氧化性,H2S具有较强还原性,发生氧化还原反应,生成的沉淀为S,生成的无色气体遇空气立即变为红棕色,则无色气体为NO,所以化学方程式为:
(5)A、HNO2 具有强氧化性,与HS?发生氧化还原反应,而不是复分解反应,错误;B、HCOOH的酸性弱于H2SO3,所以HCOOH不能与SO32?反应生成SO2和H2O,错误;C、HSO3?的酸性弱于HCOOH,所以H2SO3与HCOO?反应生成HCOOH和HSO3?,不可能生成SO32?,错误;D、二元弱酸H2SO3与对应的酸根离子SO32?反应生成酸式酸根离子HSO3?,正确。
考点:本题考查弱电解质的电离平衡、酸性强弱的比较及应用、氧化还原反应原理、方程式的书写。


科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
下列说法或表达正确的是
A.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:
C(Na+)-c(CH3COO-)=c(OH-)-c(H+)
B.向ZnS白色悬浊液中加入CuSO4溶液,有黑色沉淀产生,是因为Ksp (ZnS)<Ksp (CuS)
C.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可以制备Fe(OH)3胶体
D.热水中加入NaCl溶解至饱和后溶液的pH等于7
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如题6图.下列说法正确的是

A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:填空题
(13分)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下图:
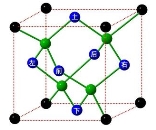
(1)一个水分子含_____个孤电子对,水分子能与很多金属离子形成配合物,请写出它与铜离子形成的一种蓝色的配合物离子的化学式为__________。
(2)每个冰晶胞平均占有____个水分子,冰的熔点远低于金刚石熔点的原因是__________________。
(3)实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键_________(填全部或部分)被破坏。
(4)假如冰晶胞边长为a cm,则冰的密度是________________g·cm-3
(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列性质比较中不正确的是
A.沸点的高低: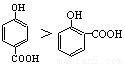 B.熔点:SiO2>CsCl>CBr4>CF4
B.熔点:SiO2>CsCl>CBr4>CF4
C.硬度:镁>铝>镁铝合金 D. 水溶性:HF>Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)向100mL 0.1mol/L醋酸溶液中加入下列物质,混合溶液有关量或性质变化趋势正确的是
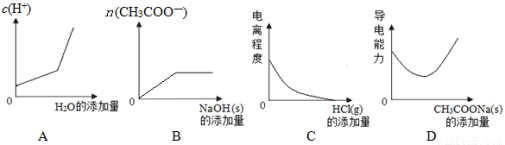
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)下列离子方程式错误的是
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.向KI溶液中加H2SO4溶液后振摇:4H+ + 4I-+ O2 = 2I2 + 2H2O
C.酸性高锰酸钾中加入草酸,溶液褪色:2MnO4- + 5H2C2O4 + 6 H+ = 2Mn2+ + 10CO2↑ +8H2O
D.证明C的非金属性强于Si的反应:SiO32- + CO2+ H2O = H2SiO3↓+ CO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com