
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。

已知:i. 
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________

(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
【答案】 烯烃 CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl HOCH2CHClCH2Cl ClCH2CH(OH)CH2Cl NaOH,H2O HOCH2CH(OH)CH2OH
CH2=CHCH2Cl+HCl HOCH2CHClCH2Cl ClCH2CH(OH)CH2Cl NaOH,H2O HOCH2CH(OH)CH2OH 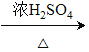 CH2=CHCHO+2H2O 取代反应
CH2=CHCHO+2H2O 取代反应 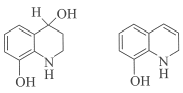 氧化 3∶1
氧化 3∶1
【解析】分析:A的分子式为C3H6,A的不饱和度为1,A与Cl2高温反应生成B,B与HOCl发生加成反应生成C,C的分子式为C3H6OCl2,B的分子式为C3H5Cl,B中含碳碳双键,A→B为取代反应,则A的结构简式为CH3CH=CH2;根据C、D的分子式,C→D为氯原子的取代反应,结合题给已知ii,C中两个Cl原子连接在两个不同的碳原子上,则A与Cl2高温下发生饱和碳上氢原子的取代反应,B的结构简式为CH2=CHCH2Cl、C的结构简式为HOCH2CHClCH2Cl或ClCH2CH(OH)CH2Cl、D的结构简式为HOCH2CH(OH)CH2OH;D在浓硫酸、加热时消去2个“H2O”生成E;根据F→G→J和E+J→K,结合F、G、J的分子式以及K的结构简式,E+J→K为加成反应,则E的结构简式为CH2=CHCHO,F的结构简式为![]() 、G的结构简式为
、G的结构简式为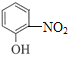 、J的结构简式为
、J的结构简式为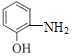 ;K的分子式为C9H11NO2,L的分子式为C9H9NO,K→L的过程中脱去1个“H2O”,结合K→L的反应条件和题给已知i,K→L先发生加成反应、后发生消去反应,L的结构简式为
;K的分子式为C9H11NO2,L的分子式为C9H9NO,K→L的过程中脱去1个“H2O”,结合K→L的反应条件和题给已知i,K→L先发生加成反应、后发生消去反应,L的结构简式为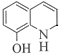 。
。
详解:A的分子式为C3H6,A的不饱和度为1,A与Cl2高温反应生成B,B与HOCl发生加成反应生成C,C的分子式为C3H6OCl2,B的分子式为C3H5Cl,B中含碳碳双键,A→B为取代反应,则A的结构简式为CH3CH=CH2;根据C、D的分子式,C→D为氯原子的取代反应,结合题给已知ii,C中两个Cl原子连接在两个不同的碳原子上,则A与Cl2高温下发生饱和碳上氢原子的取代反应,B的结构简式为CH2=CHCH2Cl、C的结构简式为HOCH2CHClCH2Cl或ClCH2CH(OH)CH2Cl、D的结构简式为HOCH2CH(OH)CH2OH;D在浓硫酸、加热时消去2个“H2O”生成E;根据F→G→J和E+J→K,结合F、G、J的分子式以及K的结构简式,E+J→K为加成反应,则E的结构简式为CH2=CHCHO,F的结构简式为![]() 、G的结构简式为
、G的结构简式为 、J的结构简式为
、J的结构简式为 ;K的分子式为C9H11NO2,L的分子式为C9H9NO,K→L的过程中脱去1个“H2O”,结合K→L的反应条件和题给已知i,K→L先发生加成反应、后发生消去反应,L
;K的分子式为C9H11NO2,L的分子式为C9H9NO,K→L的过程中脱去1个“H2O”,结合K→L的反应条件和题给已知i,K→L先发生加成反应、后发生消去反应,L 。
。
(1)A的结构简式为CH3CH=CH2,A中官能团为碳碳双键,按官能团分类,A的类别是烯烃。
(2)A→B为CH3CH=CH2与Cl2高温下的取代反应,反应的化学方程式为CH3CH=CH2+Cl2![]() CH2=CHCH2Cl+HCl。
CH2=CHCH2Cl+HCl。
(3)B与HOCl发生加成反应生成C,由于B关于碳碳双键不对称,C可能的结构简式为HOCH2CHClCH2Cl或ClCH2CH(OH)CH2Cl。
(4)C→D为氯原子的水解反应,C→D所需的试剂a是NaOH、H2O,即NaOH水溶液。
(5)D→E为消去反应,反应的化学方程式为HOCH2CH(OH)CH2OH![]() CH2=CHCHO+2H2O。
CH2=CHCHO+2H2O。
(6)F的结构简式为![]() 、G的结构简式为
、G的结构简式为 ,F→G的反应类型为取代反应。
,F→G的反应类型为取代反应。
(7)K的分子式为C9H11NO2,L的分子式为C9H9NO,对比K和L的分子式,K→L的过程中脱去1个“H2O”,结合K→L的反应条件和题给已知i,K先发生加成反应生成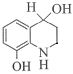 ,
, 发生消去反应生成L,补充的流程图为:
发生消去反应生成L,补充的流程图为: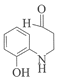
![]()

![]()
 。
。
(8)根据流程L+G→J+8-羟基喹啉+H2O,即 +
+
![]()
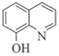 +
+ +H2O,对比L和8-羟基喹啉的结构简式,L发生了去氢的氧化反应。根据原子守恒,反应过程中L与G物质的量之比为3:1。
+H2O,对比L和8-羟基喹啉的结构简式,L发生了去氢的氧化反应。根据原子守恒,反应过程中L与G物质的量之比为3:1。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰是一种具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出)
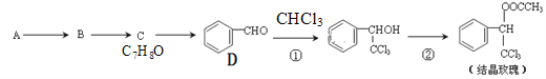
请回答下列问题:
(1)已知A是苯的一种同系物,写出A的结构简式____________。C7H8O
(2)C的同分异构体中,属于芳香族化合物的还有________种。
(3)检验D中含氧官能团的试剂名称为_______________,①的反应类型是____________。
(4)写出②的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
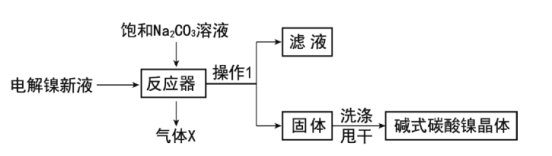
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。

(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:

资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:

(7)写出制备Ni的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,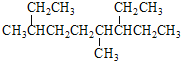 的名称为3,6-二甲基-7-乙基壬烷
的名称为3,6-二甲基-7-乙基壬烷
B.![]() 分子中所有原子共平面
分子中所有原子共平面
C.标准状况下,1L辛烷完全燃烧生成CO2 8L
D.1.0mol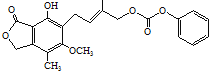 最多能与5.0molNaOH水溶液完全反应
最多能与5.0molNaOH水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛,再加热脱水可生成烯醛类化合物:CH3CHO+CH3CHO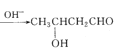
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

请回答:
(1)肉桂醛F的结构简式为____。E中含氧官能团的名称为____。
(2)写出下列转化的化学方程式
②_____。
③_____。
(3)符合下列要求的E物质的同分异构体有____种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)![]() 可溶解在
可溶解在![]() 溶液中的原因是____________________________________________________。
溶液中的原因是____________________________________________________。
(2)直接蒸发![]() 溶液,能不能得到
溶液,能不能得到![]() 晶体,其正确的操作__________________________。
晶体,其正确的操作__________________________。
(3)在![]() 溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的
溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的![]() 溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和![]() 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是

A. 甲烧杯中溶液的![]() 逐渐减小 B. 乙烧杯中发生还原反应
逐渐减小 B. 乙烧杯中发生还原反应
C. 外电路的电流方向是从![]() 到
到![]() D. 电池工作时,盐桥中的
D. 电池工作时,盐桥中的![]() 移向甲烧杯
移向甲烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com