
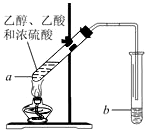
 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;分析 (1)乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水;
(2)浓硫酸加快反应速率,且吸收水;
(3)饱和碳酸钠吸收乙酸、乙醇,降低乙酸乙酯的溶解度;
(4)对左试管小火加热,由沸点可知,减少反应物挥发,同时加快反应速率;
(5)乙酸乙酯和Na2CO3溶液分层.
解答 解:(1)乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,则反应为CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)该实验中加入浓硫酸的作用为催化剂、吸水剂,故答案为:催化剂;吸水剂;
(3)饱和Na2CO3的作用是除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度便于分层,
故答案为:除去乙酸;吸收乙醇;降低乙酸乙酯的溶解度便于分层;
(4)对左试管小火加热,由沸点可知,反应开始时用酒精灯对左试管小火加热的原因是加快反应速率、同时防止反应物未来得及反应而挥发损失,
故答案为:加快反应速率;同时防止反应物未来得及反应而挥发损失;
(5)乙酸乙酯和Na2CO3溶液分层,则分离操作为分液,故答案为:分液.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、物质的性质、混合物分离、反应速率影响因素等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
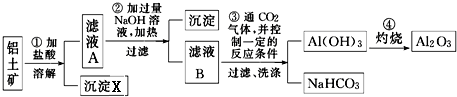
 .
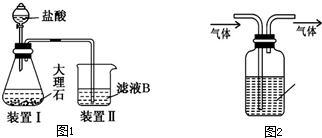
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
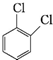
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
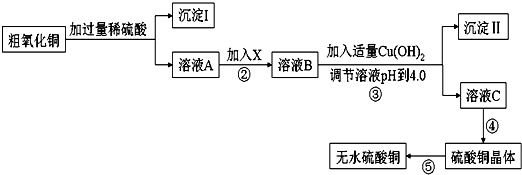
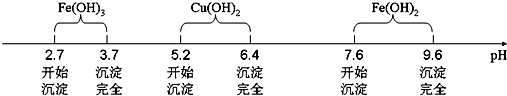
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com