
【题目】硅在氧气中完全燃烧的化学方程式为:Si+O2 ![]() SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
A.1mol
B.2mol
C.3mol
D.4mol
科目:高中化学 来源: 题型:
【题目】某铁红涂料中添加有CuO或FeO中的一种,为探究添加物的成分设计如下实验方案。
(1)请写出实验步骤、预期现象,对应的离子方程式。
(限选试剂:铁粉、3mol/LH2SO4、0.1mol/L酸性KMnO4溶液、10%H2O2、KSCN溶液)

①_____________,②_____________,_____________,③___________,_____________
④操作步骤③中反应的离子方程式为____________。
(2)经分析该铁红涂料中有FeO,为测定铁红中铁的质量分数,兴趣小组的同学称量11.6g该铁红涂料进行了如下实验。
已知:气体由草酸晶体受热分解得到:H2C2O4·2H2O ![]() CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。
CO2↑+CO↑+3H2O。且除铁红外所用试剂均过量。

①装置A、B中的试剂依次是_____、______。
②气体通入后,接下来的操作是____,然后对C装置加热。
③实验前后称得D装置增重8.8g,则此铁红中铁的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO2(g) + O2(g) = 2SO3(g)反应过程中的能量变化, 已知1mol SO2(g)完全氧化为1mol SO3的ΔH= —99kJ·mol-1,请回答下列问题:
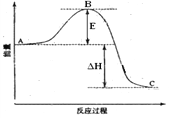
(1)图中A、C分别表的物质是__________________、________________,E的大小对该反应的焓变有无影响?___________(填“有”或“无”)(该反应通常用V2O5作催化剂,加V2O5会使图中B点降低。);
(2)图中△H = _____________kJ·mol-1;
(3)已知:S(s) + O2(g) = SO2(g) ΔH=-296 kJ·mol-1,计算由3 mol S(s)与氧气反应生成3 molSO3(g)的△H = ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境是每一个公民的责任。下列做法:
①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量施用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是( )
A.①②④⑤
B.②③④⑥
C.①②④⑥
D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中原子序数小于20的某些元素的单质的沸点与原子序数的关系,图中的原子序数是连续的. 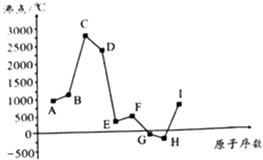
试根据图,回答下列问题:
(1)E元素在元素周期表中的位置是 .
(2)上述元素所形成的气态氢化物中最稳定的是(写化学式).
(3)上述元素中,最容易形成离子键的两种元素所形成的化合物是(写电子式).
(4)A和I两种元素相比,金属性较强的是(写元素符号),请你列举事实加以说明 .
(5)B和C的单质、A的最高价氧化物对应的水化物的水溶液三者可形成原电池,该原电池负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习,下列物质的分类不正确的是
A.SO2(氧化物)B.稀硫酸(电解质)C.HNO3(含氧酸)D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
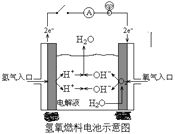
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com