
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
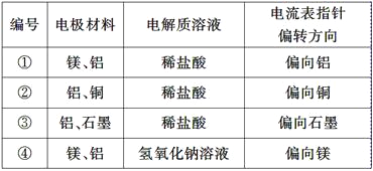
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
【答案】 不相同 负 2Al-6e-=2Al3+ 正 6H++6e-=3H2↑ 2Al+6H+=2Al3++3H2↑ 负极 铝与氢氧化钠溶液反应,镁与氢氧化钠溶液不反应 Al-3e-+4OH-=AlO2-+2H2O 另一个电极材料的活动性和电解质溶液
【解析】(1)金属与酸构成的原电池中,活泼金属作负极;
(2)实验3中Al为负极,石墨为正极,电池反应为2Al+6HCl=2AlCl3+3H2↑;
(3)实验4中发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al失去电子,Al为负极;
(4)在原电池中,失电子的极是负极,得电子的极是正极,铝在原电池中作正极或负极需要从自发进行的氧化还原反应出发。
(1)金属与酸构成的原电池中,活泼金属作负极,则实验1中Mg的活泼性大于Al,所以Al作正极,而实验2中Al的活泼性大于Cu,所以Al作负极,因此实验①、②中铝所作的电极不同;
(2)实验3中铝是活泼的金属,石墨是能导电的非金属,因此Al为负极,电极反应为2Al-6e-=2Al3+;石墨为正极,其电极反应为6H++6e-=3H2↑,因此电池总反应为2Al+6H+=2Al3++3H2↑;
(3)实验4中铝与氢氧化钠溶液反应,镁与氢氧化钠溶液不反应,而发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以铝是负极,电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(4)在原电池中金属铝作正极还是作负极,一定要看自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极,即影响铝在原电池中作正极或负极的因素为另一个电极材料的活动性和电解质溶液。


科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和D组成化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程 ,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石墨烯是烃类,属于分子晶体
B. 苯的结构特殊,分子中既没有单键也没有双键
C. 邻二甲苯只有一种结构,说明苯中所有碳碳键相同
D. 石油的分馏和煤的液化都是发生了物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的是( )
A.水的摩尔质量B.1mol水蒸气的质量
C.1mol水中水分子的个数D.1mol水蒸气的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com