
| A. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
分析 A.花生油是不饱和的酯类;
B.合金就是某种金属与其他一种或几种金属或非金属融合在一起形成的混合物;
C.同分异构体:分子式相同结构不同的化合物;
D.蛋白质要在催化剂作用下才能水解为氨基酸.
解答 解:A.花生油是不饱和的酯类,牛油是饱和酯,故A错误;
B.“不锈钢是合金”,不锈钢是铁、钴、镍的合金,故B正确;
C.棉和麻主要成分是纤维素,与淀粉不属于同分异构体,n值不同,故C错误;
D.豆浆煮沸是蛋白质发生了变性,但是蛋白质没有发生水解,蛋白质要在催化剂作用下才能水解为氨基酸,故D错误.
故选B.
点评 本题考查合金、同分异构体、油脂和蛋白质的性质,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:多选题


| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:A3++4NH3•H2O═AlO-+4NH4++2H2O | |
| B. | 少量双氧水滴人酸性KI溶液:2H202+2I-═2H++4H20+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-═3Fe3++NO+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一═2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
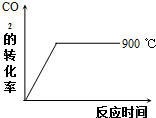 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
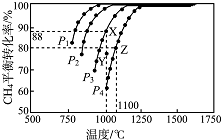 现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | △H>0 | |
| B. | P4>P3>P2>Pl | |
| C. | 1000℃,P3条件下,在Y点:v(正)<v(逆) | |
| D. | 1100℃,P4条件下,该反应的平衡常数K=l.64 (mol/L)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
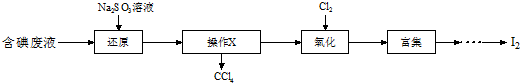

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
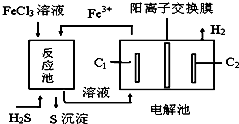
| A. | 电解池中惰性电极C1为阳极 | |
| B. | 该工艺优点之一是FeCl3溶液可循环利用 | |
| C. | 反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓ | |
| D. | 电解池总反应的化学方程式:2FeCl2+2HCl$\frac{\underline{\;通电\;}}{\;}$2FeCl3+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 乙醇(乙酸) | KOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com