
【题目】某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是
A. 肯定存在NH4+、Cl﹣、Br﹣
B. SO42﹣、SO32﹣至少含有一种
C. 是否存在Na+需要通过焰色反应来确定
D. 肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
【答案】B
【解析】无色溶液中不存在有色的Cu2+;根据①加入足量氯水,无气体产生可知原溶液中不存在CO32-,再加入CCl4溶液分层,下层为橙红色,说明存在Br-;将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g,该沉淀为硫酸钡,2.33g硫酸钡的物质的量为: ![]() =0.01mol,说明原溶液中含有SO42-、SO32-中的至少一种离子,且物质的量之和为0.01mol,一定不存在Ba2+;根据③可知生成的气体为氨气,其物质的量为:
=0.01mol,说明原溶液中含有SO42-、SO32-中的至少一种离子,且物质的量之和为0.01mol,一定不存在Ba2+;根据③可知生成的气体为氨气,其物质的量为: ![]() =0.02mol,说明原溶液中含有0.02molNH4+;由于溶液中含有溴离子,根据电荷守恒可知原溶液中负电荷的物质的量一定大于0.02mol,而正电荷只有0.02mol,说明溶液中一定还含有Na+。根据上述分析可知,溶液中一定含有的离子为:Na+、NH4+、Br-及SO42-、SO32-中的至少一种离子;一定不存在的离子为:Ba2+、Cu2+、CO32-,不能确定的离子为Cl-。A.肯定存在NH4+、Br-,无法确定是否含有Cl-,故A错误;B.根据分析可知,SO42-、SO32-至少含有一种,故B正确;C.根据分析可知,溶液中一定含有Na+,不需要通过焰色反应检验,故C错误;D.肯定不存在Ba2+、Cu2+、CO32-,可能含有SO32-,故D错误;故选B。
=0.02mol,说明原溶液中含有0.02molNH4+;由于溶液中含有溴离子,根据电荷守恒可知原溶液中负电荷的物质的量一定大于0.02mol,而正电荷只有0.02mol,说明溶液中一定还含有Na+。根据上述分析可知,溶液中一定含有的离子为:Na+、NH4+、Br-及SO42-、SO32-中的至少一种离子;一定不存在的离子为:Ba2+、Cu2+、CO32-,不能确定的离子为Cl-。A.肯定存在NH4+、Br-,无法确定是否含有Cl-,故A错误;B.根据分析可知,SO42-、SO32-至少含有一种,故B正确;C.根据分析可知,溶液中一定含有Na+,不需要通过焰色反应检验,故C错误;D.肯定不存在Ba2+、Cu2+、CO32-,可能含有SO32-,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】海带中含碘元素。从海带中提取碘有如下步骤:①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是( )
A. ①②③④⑤ B. ②⑤①③④ C. ①③⑤②④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①烧杯、②坩埚、③锥形瓶、④蒸发皿、⑤试管、⑥烧瓶、⑦表面皿,用酒精灯加热时,需要垫石棉网的是
A. ②④⑤ B. ①⑥⑦
C. ③④⑥ D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4HS(s) ![]() NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况下,不会使平衡发生移动的是
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况下,不会使平衡发生移动的是
A. 温度、容积不变时,通入SO2气体 B. 将NH4HS固体全部移走
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,将一定量的氢气和氮气的混合气体充入等压密闭容器中进行反应,达到平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为
A. 25% B. 27.5 % C. 30% D. 37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23gNa与足量H2O反应完全后失去2NA个电子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4LN2和H2混合气中含2NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去9NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
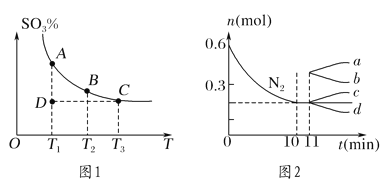
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都为22.4 L
B. 1 mol任何物质在标准状况下所占的体积都为22.4 L
C. 标准状况下,1 mol水所占的体积是22.4 L
D. 标准状况下,22.4 L的任何气体的物质的量都是1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com