
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
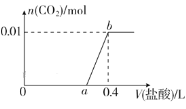
A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
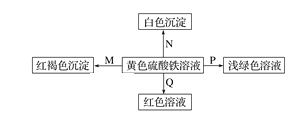
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,有少量的Fe、Mg杂质)制备明矾的过程如图所示。回答下列问题:

(1)操作1中用到的玻璃仪器有________________。
(2)为尽量少引入杂质,从易拉罐溶解至生成Al(OH)3,过程中,主要发生反应的离子反应方程式为______________,__________________________;试剂②是_______________________________。
(3)已知:常温下KW=1.0×10-14 ,Al(OH)3溶于NaOH溶液反应的平衡常数等于20。则Al(OH)3+H2O[Al(OH)4]-+H+平衡常数K=_________________。
(4)天然水在净化处理过程中加入明矾作混凝剂,水的净化和软化的区别是______________。
(5)普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂覆明矾的工艺有关,请说明理由:_____________________;为保护这些纸质文物,有人建议采取喷洒Zn(C2H5)2的方法,其可以与水反应生成氧化锌和乙烷。用反应方程式表示该方法生成氧化锌及防止酸性腐蚀的原理________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为_____。
(2)把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g;则原混合物中Na2CO3的物质的量为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
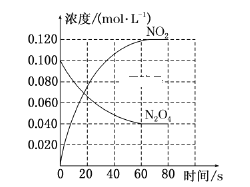
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所列物质中,属于电解质的是__________(填序号,下同),属于非电解质的是________,属于强电解质的是__________,属于弱电解质的是________。
①CH3CH2OH ②CH3COOH ③熔融态KNO3 ④SO3 ⑤蔗糖 ⑥HClO ⑦NaHCO3 ⑧氨水 ⑨Cl2 ⑩BaSO4 Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com